PRÊMIO PITANGA SANTOS
ESTUDO COMPARATIVO DOS EFEITOS DE DOIS CORTICOSTERÓIDES SINTÉTICOS, DEFLAZACORT E PREDNISONA, NA CICATRIZAÇÃO DE ANASTOMOSES COLÔNICAS DE RATOS
Mauro Toledo Sirimarco TSBCP
Sergio Zucoloto
Francisco Aprille - TSBCP
SIRIMARCO M.T., ZUCOLOTO S., APRILLE F. _ Estudo comparativo dos efeitos de dois corticosteróides sintéticos, Deflazacort e Prednisona,
na cicatrização de anastomoses colônicas de
ratos. _ Rev bras Coloproct, 2001; 21(3): 167-195.
resumo: Com o objetivo de comparar os efeitos de dois corticosteróides sintéticos a prednisona e o
deflazacort, na cicatrização
de anastomoses no intestino grosso, noventa ratos foram estudados. Trinta ratos receberam 1,25mg/kg/dia de
prednisona, trinta
receberam 1,5 mg/kg/dia de deflazacort e trinta animais (grupo controle) receberam solução de cloreto de sódio a 0,9%. As drogas foram
administradas por gavagem desde sete dias antes da cirurgia até a data do
sacrificio. Os animais foram submetidos a ressecção segmentar do
cólon distal e reconstituição do trânsito intestinal por anastomose término-terminal, em plano único, com sutura contínua invaginante
de polipropileno 6-0. De acordo com o sorteio do subgrupo a que pertenciam, os animais foram sacrificados com três, sete e quatorze
dias. O peso corporal, a evolução clínica, a cavidade abdominal, os aspectos macro e microscópicos da anastomose e a concentração
tecidual de hidroxiprolina de cada animal foram observados. O deflazacort provocou menos efeitos deletérios à cicatrização do que a
prednisona, pois no estudo bioquímico não houve diminuição da concentração tecidual de hidroxiprolina nas anastomoses colônicas de ratos
tratados com o deflazacort, sacrificados no terceiro e sétimo dias pós-operatórios. Pela
histopatologia, ambos corticosteróides reduziram,
de maneira semelhante, a intensidade da reação inflamatória aguda do processo cicatricial e a concentração de fibroblastos no terceiro
e sétimo dias pós-operatórios.
1-INTRODUÇÃO
Pela ação de vários fatores sintetizados por
macrófagos, plaquetas, células endoteliais e linfócitos T, um
ferimento desencadeia uma cascata organizada e complexa de
eventos celulares e bioquímicos que resultam na reparação do
tecido lesado. A cicatrização é o processo de reparo tecidual
no qual o tecido lesado é substituído por tecido
conjuntivo fibroso (CLARK, 1996; STEED, 1997).
O processo de cicatrização das feridas pode ser
dividido didaticamente em três fases distintas, porém,
superpostas: (1) hemostasia e inflamação, (2) fibroplasia e (3)
maturação ou remodelagem. Qualquer falha ou prolongamento em
uma fase pode resultar em retardo da cicatrização ou
ausência de fechamento da ferida. As falhas na cicatrização
das feridas continuam sendo um problema clínico
significativo, com grande impacto sobre os custos na assistência à
saúde (STEED, 1997; WITTE & BARBUL, 1997).
Muitos conceitos referentes à cicatrização têm
sido formulados com base em observações de feridas na
pele: após a hemostasia, ocorre a instalação de uma
reação inflamatória cujo exsudato de células fagocitárias
reabsorve o sangue extravasado e os produtos da destruição
tecidual. Em seguida, há proliferação fibroblástica e endotelial
que dá origem ao tecido de granulação. Os
fibroblastos desenvolvem grande atividade sintetizadora de
colágeno, proteína que se constitui no componente essencial das
fibras do tecido conjuntivo dos metazoários em geral. O
tecido conjuntivo frouxo, rico em capilares sangüíneos,
contém leucócitos e matriz extracelular formada por fibras
colágenas finas (colágeno tipo III), ácido hialurônico e
moderada quantidade de proteoglicanos. A quantidade de
colágeno aumenta com o tempo e com cerca de duas semanas
suas fibras passam a predominar na matriz extracelular.
O colágeno do tipo I, tendo fibras mais grossas e
compactas, adquire proeminência em relação ao tipo III. Esse
tecido cicatricial permanece dinâmico nas semanas seguintes:
o colágeno vai sendo remodelado, com aumento das
ligações transversais, tornando-se mais resistente e
estável (FORREST, 1983; PEREIRA, 1993; CLARK,
1996; ECKES et al., 1996).
O colágeno, glicoproteína composta por três
cadeias polipeptídicas em conformação de tríplice hélice,
é constituído principalmente pelos aminoácidos
glicina, alanina, lisina, prolina, hidroxilisina e hidroxiprolina. A
prolil-hidroxilase transforma a prolina em hidroxiprolina, que
passa a ser um aminoácido exclusivo do colágeno. A
hidroxiprolina está presente em proporções elevadas no colágeno,
sendo indispensável para a estabilidade da tríplice hélice
da proteína (MILLER, 1976; PEREZ-TAMAYO,
1978; FORREST, 1983; PROCKOP & KIVlRIKKO, 1995).
A resposta celular na cicatrização é similar nos
diversos tecidos, mas a duração e a magnitude de cada fase
da seqüência cicatricial podem variar (BALLANTYNE,
1983; HENDRIKS & MASTBOOM, 1990; MAST, 1997; THORNTON & BARBUL, 1997). Há
também significativas diferenças no metabolismo do
colágeno quando se comparam cicatrizações da pele e do
intestino (HASTINGS et al., 1975; KLEIN &
CHANDRARAJAN, 1977; THORNTON & BARBUL, 1997).
As discrepâncias entre os tecidos suscitam
crescente número de pesquisas sobre a ação de variados agentes
na cicatrização de anastomoses intestinais, sobretudo
porque a deiscência anastomótica é a mais grave complicação
nas intervenções cirúrgicas do intestino grosso, por
estar acompanhada de elevada morbi-mortalidade
(BEAHRS, 1967; GOLIGHER et al., 1970; DEBAS &
THOMSON, 1972; MORGENSTERN et al., 1972; FIELDING
et al., 1980).
O conhecimento para a realização de cirurgia no
intestino desenvolveu-se gradualmente, de uma concepção
mística para um caráter científico ao longo dos
tempos, possibilitando que as operações se tornassem,
atualmente, procedimentos freqüentes. Por ser difícil examinar
os mecanismos da cicatrização intestinal em modelos
clínicos, exceto pela análise retrospectiva, aprendeu-se muito
pelo estudo de modelos animais, com suas limitações
aceitas (THORNTON & BARBUL, 1997).
Nos últimos dois séculos, a cicatrização de
anastomoses intestinais vem sendo estudada de modo veemente
por pesquisadores, com muita ênfase às técnicas de sutura
e materiais empregados na confecção das
anastomoses (BALLANTYNE, 1984). Em 1923, KERR relatou
que, àquela época, já haviam sido descritos cerca de duzentos
e cinquenta métodos de sutura intestinal. HALSTED
(1887) afirmou que a submucosa é a camada intestinal
mais importante a ser incluída na sutura. Esse princípio
continua aceito como verdadeiro por ser a submucosa a
camada que possui maior teor de colágeno, proteína que
confere sustentação à parede intestinal e que é fundamental
no processo cicatricial (LORD et al., 1977; KLOPPER,
1986). Por conseguinte, qualquer que seja a técnica
cirúrgica utilizada, o cirurgião deverá incluir a camada
submucosa na sutura intestinal.
Todavia, pode ocorrer deiscência mesmo quando
a anastomose é feita com todo rigor técnico, uma vez
que fatores locais e sistêmicos são também
considerados importantes quando se analisa a cicatrização
(HAWLEY, 1973). Em condições ideais, uma anastomose deve ser
bem vascularizada, realizada sem tensão e livre de
contaminação bacteriana (RAVO, 1988). Também é importante que
as bordas a serem anastomosadas sejam sadias, pois a
presença de inflamação ou neoplasia propicia maior risco
de deiscência (SCHROCK et al., 1973). Dependendo da
dose utilizada, a radioterapia pode provocar alterações
locais indesejáveis, tais como isquemia secundária à
endarterite obliterante e redução no fluxo sangüíneo colônico,
podendo resultar em complicações anastomóticas (BLAKE
et al., 1984; MORGENSTERN et al., 1984; ORMISTON,
1985; MILSOM et al., 1992; THORNTON & BARBUL, 1997).
Em considerável número de pesquisas,
demonstra-se que vários outros fatores podem prejudicar o processo
de cicatrização das anastomoses intestinais, tais como
anemia, hipotensão arterial e transfusão sanguínea
intra-operatórias (SCHROCK et al., 1973); hipovolemia (GILMOUR
et al., 1980); isquemia intestinal (COHEN
et al., 1985; IKEDA et al., 1988); baixa tensão de oxigênio (SHERlDAN
et al., 1987); neop1asia maligna avançada (IRVIN &
GOLIGHER, 1973; STEWART , 1973); desnutrição (DALY
et al., 1972; IRVIN & GOLIGHER, 1973; IRVIN & HUNT,
1974; IRVIN, 1978); desidratação (HARTMANN
et al., 1992); fixação tumoral (IRVIN & GOLIGHER, 1973);
uremia (COLIN et al., 1979; VIANNA et
al., 1981); idade avançada do paciente (IRVIN & GOLIGHER, 1973; SCHROCK
et al., 1973) e agentes farmacológicos, entre outros.
Dentre os agentes farmacológicos, os
antiinflamatórios têm despertado o interesse dos pesquisadores, porque
essas drogas têm o potencial de interferir nas fases de
inflamação e de fibroplasia do processo cicatricial.
Os antiinflamatórios não-esteroidais têm vasta
utilização clínica, mas seus efeitos sobre a cicatrização
de anastomoses intestinais têm sido pouco
pesquisados. BRENNAN et al. (1984), estudando anastomoses
colônicas em ratos, relataram que o flurbiprofen favorece
a cicatrização, aumentando a produção de colágeno, sem
ter efeito sobre a atividade colagenolítica. SOARES
(1996), pesquisando os efeitos do ácido 5-aminossalicílico
sobre as anastomoses colônicas de ratos, notou elevação
da concentração de hidroxiprolina no sétimo e no
décimo quarto dias pós-operatórios sem que ocorressem
alterações no padrão histopatológico da cicatrização.
Todavia, CALACHE NETO et al. (1992) observaram
efeitos adversos do antiinflamatório diclofenaco
sódico administrado no período pós-operatório em
ratos submetidos a suturas cólicas. SOUSA (1994) concluiu
que a cicatrização de anastomoses colônicas em coelhos
também foi prejudicada pelo diclofenaco sódico, quer
administrado por 7 dias no período pré-operatório, quer no
pós-operatório ou nos períodos pré e pós-operatórios. MASTBOOM
et al. (1991a) estudaram a influência de quatro
drogas antiinflamatórias não-esteroidais (piroxicam,
ibuprofen, ácido acetilssalicílico e indometacina) sobre
anastomoses intestinais em ratos e verificaram aumento na
suscetibilidade às infecções, resultando em índices elevados de
morbidade e mortalidade.
Os antiinflamatórios esteroidais
(corticosteróides) também têm sido muito utilizados, atuando
terapeuti-camente em várias doenças, inclusive em pacientes
com doença inflamatória intestinal (MICHENER &
WYLLIE, 1990; HADDAD, 1997; KOTZE & PAROLIN, 1997).
Os corticosteróides sintéticos são as drogas mais
comumente prescritas para pacientes com colite ulcerativa e doença
de Crohn, em atividade, nos graus moderados e
graves (HANAUER & BAERT, 1994; STEIN &
HANAUER, 1999). Muitas vezes, esses pacientes precisam ser
operados na vigência da terapêutica hormonal.
Pelo fato dos corticosteróides prejudicarem
a cicatrização de feridas na pele (HOWES
et al., 1950; SANDBERG, 1964; EHRLICH & HUNT,
1968; EHRLICH & HUNT, 1969; EHRLICH et
al., 1973), os cirurgiões têm, quase sempre, dúvidas quanto
a confeccionarem ou não uma anastomose intestinal
em pacientes na vigência do tratamento com
corticosteróides, devido à crença de que essas drogas poderiam
aumentar os riscos de complicações também nas suturas intestinais.
Entretanto, nunca foi comprovado de maneira inequívoca, que a corticoterapia prejudica a
cicatrização de anastomoses intestinais em estudos tanto clínicos
quanto experimentais (THORNTON & BARBUL, 1997).
Os efeitos dos corticosteróides na cicatrização de suturas
do intestino grosso têm sido pouco descritos na literatura
e mostram resultados conflitantes. Há autores que,
estudando animais, observaram algumas alterações
deletérias provocadas pelos corticosteróides no processo
cicatricial de anastomoses colônicas (HOUSTON &
ROTSTEIN, 1988; PHILLIPS et al., 1992; CALI
et al., 1993; KIM et al., 1993; FURST
et al., 1994; DEL RIO et al., 1996). Entretanto, MASTBOOM
et al. (1991b) demonstraram que a cicatrização de anastomoses colônicas em ratos
não foi afetada pela administração de metilprednisolona a
curto prazo, não tendo havido diminuição nem na pressão
de ruptura das anastomoses, nem nos níveis de
hidroxiprolina nas anastomoses intestinais. EUBANKS
et al. (1997) também não encontraram diminuição nas resistências
das anastomoses colônicas de ratos, medidas pela pressão
de ruptura, mesmo quando os animais foram tratados
com dosagens elevadas de três diferentes
corticosteróides (hidrocortisona, metilprednisolona ou dexametasona).
A prednisona é um glicocorticóide sintético,
com propriedades antiinflamatórias e imunossupressoras,
que tem sido indicada para o tratamento das
doenças inflamatórias intestinais. Ela é uma das drogas mais
eficazes para o tratamento da fase ativa da colite ulcerativa e
da doença de Crohn, independentemente da localização
das lesões (HADDAD, 1997). A prednisona,
empregada sistemicamente, é benéfica aos pacientes,
promovendo alívio dos sintomas; mas os efeitos colaterais limitam
seu uso, particularmente quando a terapia hormonal
é prolongada (LEWIS et al., 1971; SWARTZ &
DLUHY, 1978; BOTOMAN et al., 1998).
Novos corticosteróides têm surgido, com a
mesma eficácia terapêutica de velhas formulações hormonais,
tendo a vantagem de apresentarem menos efeitos
indesejáveis, como é o caso do deflazacort. Essa nova droga é
um glicocorticóide sintético derivado da prednisolona. A
potente ação antiinflamatória do deflazacort tem sido
comparada com a da prednisona, tendo o benefício de apresentar
menos efeitos colaterais, tais como reduzido efeito
diabetogênico (BUNIVA et al., 1979; CRISCUOLO
et al., 1980; PAOANO et al., 1982; CAVALLO-PERIN
et al., 1984; BRUNO et al., 1987; ARIZON
et al., 1993; GOBBI & SCUDELETTI, 1993; SCUDELETTI
et al., 1993; KIM et al., 1997), mínima compleição cushingóide (GRAY
et al., 1991; MESSINA et al., 1992; ARIZON
et al., 1993; BROYER et al., 1997; LIPPUNER
et al., 1998) e menor risco de osteoporose (GENNARl & IMBIMBO,
1985; BALSAN et al., .1987; GRAY et
al., 1991; LOFTUS et al., 1991; MESSINA
et al., 1992; GENNARl, 1993; SCUDELETTI et
al., 1993; RIZZATO et al., 1997; LIPPUNER
et al., 1998; LOCASCIO et al., 1998).
O deflazacort vem sendo empregado com eficácia
no tratamento de várias doenças e, assim como a
prednisona, também atua terapeuticamente nas doenças
inflamatórias intestinais (MARKHAM & BRYSON, 1995).
Apesar da vasta utilização clínica da prednisona, há
uma lacuna na literatura sobre trabalhos experimentais
que focalizem os efeitos desse corticosteróide na
cicatrização de anastomoses colônicas.
Quanto ao deflazacort, SIRIMARCO (1998) e SIRIMARCO
et al. (1999) demonstraram que a droga modifica os indicadores histopatológicos da cicatrização
de anastomoses colônicas de ratos, diminuindo os
fenômenos exsudativos da inflamação e retardando os
fenômenos reparativos do processo cicatricial, todavia sem alterar
a concentração tecidual de hidroxiprolina, não
tendo provocado deiscências anastomóticas. Considerando-se
os resultados obtidos no experimento relatado acima, em
que o deflazacort modifica o processo, mas não interrompe
a cicatrização colônica, e que, clinicamente, o
deflazacort tem apresentado menos efeitos colaterais que a
prednisona em doses antiinflamatórias equivalentes, foi formulada
a hipótese de que o deflazacort provocaria menos
efeitos deletérios à cicatrização de anastomoses colônicas do
que a prednisona. Para testar essa proposição, utilizamos o
rato como modelo experimental no presente estudo.
2 - MATERIAIS E MÉTODOS
2.1 - ANIMAL DE EXPERIMENTAÇÃO
Foram utilizados noventa ratos, Rattus
norvegicus, linhagem Wistar, machos, aparentemente sadios, com peso corporal
inicial entre 300 e 340 gramas e com 60 a 80 dias de vida.
Os animais foram alimentados com dieta padrão
de laboratório (Labina®, Ração para Ratos, Camundongos
e Hamsters - Ralston Purina do Brasil Ltda. - Paulínia -
SP) e água à vontade. Todos os animais foram
submetidos, após anestesia, à ressecção de um segmento
padronizado do intestino grosso, com confecção imediata da
anastomose para restabelecimento do trânsito intestinal, de acordo
com as normas institucionais para os cuidados com animais
de experimentação.
2.2 - DISTRIBUIÇÃO DOS ANIMAIS
Foram constituídos três grupos com trinta animais:
GRUPO D (= Grupo Deflazacort)
Os trinta ratos desse grupo receberam a droga
Deflazacort (Calcort®, Merrel Lepetit Farmacêutica e Industrial Ltda.
- Santo Amaro - SP), na dose de 1,5 mg/kg/dia. A
medicação foi administrada por gavagem, uma vez ao dia desde
sete dias antes da cirurgia até o dia do sacrifício.
A solução para administração foi obtida pela
dissolução e homogeneização de um comprimido de Deflazacort de
6 mg em 12 ml de Solução de Cloreto de Sódio a
0,9% (Fresenius Laboratórios Ltda. - Campinas - SP), o
que perfazia uma dose-volume de 3 ml/kg/dia.
A gavagem foi realizada através de catéter plástico
tipo Levine (Ibrasgamma, Ibras-CBO Indústrias Cirúrgicas
e Ópticas S.A. - Campinas - SP), número 6, introduzido
desde a boca até o estômago, adaptado a uma seringa de 3ml
que continha a solução.
O grupo D foi subdividido em três subgrupos, com
dez animais cada, de acordo com o dia do sacrifício:
Subgrupo D3: animais sacrificados três dias após a cirurgia;
Subgrupo D7: animais sacrificados sete dias após
a cirurgia;
Subgrupo D14: animais sacrificados quatorze dias
após a cirurgia.
GRUPO P (= Grupo Prednisona)
Os trinta ratos desse grupo receberam a droga
Prednisona (Meticorten®, Indústria Química e Farmacêutica
Schering-Plough S/A - Rio de Janeiro - RJ), na dose de 1,25
mg/kg/dia. A medicação foi administrada por gavagem, uma vez
ao dia, desde sete dias antes da cirurgia até o dia do sacrifício.
A solução para administração foi obtida pela
dissolução e homogeneização de um comprimido de Prednisona de
5 mg em 10 ml de Solução de Cloreto de Sódio a
0,9% (Fresenius Laboratórios Ltda. - Campinas - SP), o
que perfazia uma dose-volume de 2,5 ml/kg/dia.
A gavagem foi realizada através do mesmo método e
com os mesmos materiais descritos acima para o grupo deflazacort.
O grupo P foi subdividido em três subgrupos, com
dez animais cada, de acordo com o dia do sacrifício:
Subgrupo P3: animais sacrificados três dias após
a cirurgia;
Subgrupo P7: animais sacrificados sete dias após
a cirurgia;
Subgrupo P14: animais sacrificados quatorze dias
após a cirurgia.
GRUPO C (= Grupo Controle)
Os trinta ratos deste grupo receberam o volume correspondente a 3 ml/kg/dia de Solução de Cloreto de
Sódio a 0,9% (Fresenius Laboratórios Ltda. - Campinas -
SP), mediante o mesmo procedimento de gavagem, uma vez
ao dia, desde sete dias antes da cirurgia até o dia do sacrifício.
Este grupo foi subdividido em três subgrupos, com
dez animais cada, de acordo com o dia do sacrifício:
Subgrupo C3: animais sacrificados três dias após
a cirurgia;
Subgrupo C7: animais sacrificados sete dias após
a cirurgia;
Subgrupo C14: animais sacrificados quatorze dias
após a cirurgia.
2.3 - PRÉ-OPERATÓRIO
As intervenções cirúrgicas foram realizadas em
sessões, nas quais lotes de nove animais eram operados. Os
animais foram destinados aos grupos e subgrupos por
sorteio, efetuado sete dias antes do ato cirúrgico, para
que recebessem o Deflazacort (Grupo D), a Prednisona
(Grupo P) ou a Solução de Cloreto de Sódio a 0,9% (Grupo
C). Foram preparadas nove fichas idênticas com
as denominações D3, D7, D14, P3, P7, P14, C3, C7 e
C14. Um técnico do laboratório de cirurgia experimental
efetuava o sorteio, fazia uma marca na orelha do animal
para identificá-lo, pesava-o e iniciava a gavagem. Os
nove animais permaneciam depois na mesma gaiola,
recebendo água e ração à vontade.
No dia da cirurgia os animais também recebiam a
droga ou o placebo. Após a gavagem, permaneciam em
jejum por seis horas, até o momento do ato operatório.
Criteriosamente antes da anestesia, os animais
tinham os seus pesos aferidos e anotados pelo técnico do
laboratório de cirurgia experimental, que os preparava para a
cirurgia, sem que o cirugião soubesse a quais subgrupos
pertenciam os animais.
2.4 - ANESTESIA
Os animais foram submetidos à anestesia geral
inalatória com éter sulfúrico, sendo considerados anestesiados
quando apresentaram respiração regular e superficial, além de
flacidez da musculatura esquelética, com ausência de reflexos.
A anestesia foi mantida com a utilização de cone
nasal contendo algodão embebido em éter.
2.5 - TÉCNICA OPERATÓRIA
As figuras 1,2,3 e 4 ilustram o procedimento
cirúrgico, que foi realizado com material limpo, não esterilizado.
 |
 |
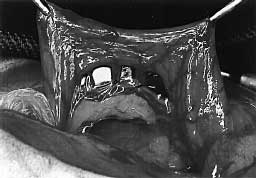
| Figura 1. Ligadura dos ramos terminais veno-arteriais do segmento colônico a
ser ressecado, que está exposto com o auxílio de um afastador de parede abdominal e de
uma gaze deslocando as demais vísceras. |
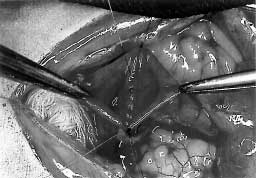
Figura 2. Reparo das bordas laterais do cólon com pontos separados. Início da
sutura contínua na borda mesentérica.
|
 |
 |
|
Figura 4. Anastomose colônica concluída.
|
A intervenção cirúrgica foi realizada obedecendo
à seqüência padronizada de etapas propostas por
OLIVEIRA (1989), realizando-se a anastomose com sutura contínua
à semelhança da técnica proposta por ROCHA (1989):
a) imobilização do animal em decúbito dorsal,
sobre placa de madeira, pela fixação de seus membros com
fita de esparadrapo;
b) depilação da parede abdominal anterior;
c) antissepsia da pele do abdome com solução
de polivinilpirrolidona-iodo, com 1% de iodo ativo
(Povidine® degermante, Johnson - Rio de Janeiro - RJ);
d) laparotomia mediana de 4 cm de extensão, com
sua extremidade caudal a 0,5 cm da genitália externa do animal;
e) colocação de afastador auto-estático na
parede abdominal;
f) afastamento das vísceras com gaze embebida em
solução de cloreto de sódio a 0,9% para exposição do cólon
distal;
g) malaxação divergente, caso o segmento intestinal
a ser operado apresentasse conteúdo fecal;
h) ligadura e secção distal dos ramos terminais
veno-arteriais de um segmento colônico compreendido entre
2,5 e 3,5 cm, cranialmente à reflexão peritoneal;
i) ressecção de um segmento colônico de 1cm, por
secção com tesoura reta, ficando a extremidade caudal a 2,5
cm da reflexão peritoneal;
j) reconstituição do trânsito colônico com
anastomose término-terminal, em plano único, com sutura
contínua iniciada na porção mesentérica com o nó voltado para
dentro da luz intestinal, englobando todas as camadas da
parede intestinal, com pontos invaginantes distantes entre si de 1
a 2 mm, terminando com o nó na superficie serosa da
borda antimesentérica, utilizando-se fio de polipropileno 6-0
com duas agulhas cilíndricas de 1,3 cm (Prolene®, Ethicon
- São José dos Campos - SP);
1) síntese da parede abdominal em dois planos -
o primeiro, incluindo o peritônio, músculo e aponeurose
da linha média, com sutura contínua simples; e o segundo,
o tecido subcutâneo e a pele, com sutura contínua em
barra grega - ambos com fio de náilon monofilamentar 4-0
com agulha cilíndrica de 2,5 cm (Mononylon®, Ethicon -
São José dos Campos - SP).
2.6 - PÓS-OPERATÓRIO
Após a recuperação anestésica, os animais
foram colocados em gaiolas, em grupos de nove, com água
e ração à vontade. Uma vez ao dia, eram submetidos
à gavagem para receberem deflazacort, prednisona ou
solução de cloreto de sódio até a data do sacrifício.
Procurou-se observar a ocorrência de apatia,
diarréia ou distensão abdominal entre os animais.
2.7 - REOPERAÇÃO E ESTUDO MACROSCÓPICO
Os animais foram reoperados nos dias
previamente determinados pelo sorteio, ou seja, com três, sete
ou quatorze dias após a cirurgia. Antes da anestesia, o peso
de cada animal foi aferido e anotado.
Após a anestesia geral inalatória com éter sulfúrico
e imobilização do animal em decúbito dorsal sobre placa
de madeira, a parede abdominal era aberta amplamente.
A cavidade abdominal era, então, estudada com o
objetivo de serem identificadas eventuais deiscências de sutura
da anastomose, aderências, abscessos ou
peritonite generalizada.
Após o inventário da cavidade abdominal, era
ressecado um segmento intestinal de aproximadamente 2cm,
contendo a anastomose em sua porção central. O segmento era
aberto longitudinalmente na porção mesentérica e fixado em
papel cartão. A seguir, nova secção longitudinal dividia o
segmento preparado em duas partes semelhantes. Aleatoriamente,
uma parte do intestino era imersa em solução de cloreto de
sódio a 0,9% e congelado a -20°C para ser utilizado
posteriormente para estudo da concentração de hidroxiprolina. A outra
parte era fixada em solução de formol tamponado a 10% para
a avaliação histopatológica.
Em seguida, aprofundava-se a anestesia até que
os animais apresentassem parada cardiorrespiratória e óbito.
2.8 - HISTOPATOLOGIA
Após a fixação em formol tamponado a 10%, as
peças foram preparadas e coradas pela hematoxilina-eosina
e pelo tricrômico de Masson. A avaliação
histopatológica foi realizada por microscopia óptica por um
observador que desconhecia a que grupo ou subgrupo pertencia
o animal.
As condições de cicatrização foram
analisadas considerando-se os seguintes indicadores
(OLIVEIRA, 1989; SOUSA, 1989):
- crosta fibrino-leucocitária;
- necrose focal;
- depósitos de fibrina;
- exsudato neutrofílico;
- edema;
- dilatação linfática;
- congestão vascular;
- hemorragia focal;
- exsudato eosinofilico;
- regeneração mucosa;
- infiltrado mononuclear;
- infiltração macrolágica;
- granulomas;
- neoformação vascular;
- proliferação fibroblástica;
- fibrose.
Cada indicador foi analisado e classificado em escores:
( ) ausente
( + ) leve
( + + ) moderado
( + + + ) intenso
2.9 - ESTUDO BIOQUÍMICO
As concentrações de hidroxiprolina nos segmentos
que continham a cicatriz anastomótica foram determinadas
após a retirada cuidadosa dos fios de sutura.
2.9.1 - EXTRAÇÃO DA HIDROXIPROLINA
O processo de extração da hidroxiprolina foi
realizado segundo a técnica proposta por STEGEMANN
& STALDER (1967) e modificada por MEDUGORAC (1980), suprimindo-se a fase de secagem em estufa a
vácuo. O tecido passou pelas seguintes etapas:
a) pesagem e permanência em estufa a 90°C por
4 horas;
b) nova pesagem, agora com o tecido seco;
c) hidrólise em ampola fechada contendo HCl 6N (1
ml para cada 10 mg de tecido seco), em estufa à
temperatura entre 107 e 110°C por 18 horas;
d) adição de 100 mg de carvão ativado puro e 20
ml de tampão citrato/acetato com pH 6, assim preparado:
50 g de ácido cítrico, 12 ml de ácido acético, 120 g de
acetato de sódio e 34 g de hidróxido de sódio dissolvidos em
água deionizada até completar o volume de 1000 ml, com
10 gotas de tolueno adicionadas como preservativo;
e) adição de água deionizada, completando-se até
50 ml, seguindo-se agitação vigorosa em agitador de tubos;
f) filtragem da solução.
2.9.2 - DETERMINAÇÃO DA HIDROXIPROLINA
A determinação da hidroxiprolina foi efetuada segundo
a técnica de STEGEMANN & STALDER (1967), que
utiliza a cloramina-T como agente oxidante da hidroxiprolina,
na presença de solução tampão (pH 6) e solução de
para-amino-benzaldeído perclórico (aldeído/HC104), como indutor
do acoplamento do cromógeno formado.
O extrato passou, então, pelas seguintes etapas
de processamento:
a) em um tubo de ensaio contendo 2ml do
extrato obtido foi adicionado, à temperatura ambiente, 1ml
de uma solução preparada com: 1,41g de cloramina-
T, dissolvida em 10ml de água deionizada, 10ml de
propanol e 80ml de tampão citrato/acetato pH 6. Agitação
vigorosa do tubo;
b) após 20 minutos, adicionou-se 1 ml de uma
solução preparada com: 15 g de dimetilamino benzaldeído, 60
ml de propanol e 26 ml de ácido perclórico, completando-se
o volume para 100 ml com propanol. Agitação vigorosa
do tubo durante 30 segundos;
c) banho-maria a 60°C durante 15 minutos;
d) resfriamento em água corrente por 10 minutos;
e) após ajuste do aparelho com o
blank e realização de curva padrão, utilizando-se soluções de
concentrações conhecidas de hidroxiprolina (0,5 µg/ml, 1 µg/ml, 2
µg/ml, 4 µg/ml e 8 µg/ml), procedeu-se à leitura
espectrofo-tométrica. Foi lida a absorvância para cada amostra,
no comprimento de onda de 550 nm, e calculada a
con-centração.
2.10 - ANÁLISE ESTATÍSTICA
As variações dos pesos dos animais, os
achados histopatológicos e as diferentes concentrações
de hidroxiprolina foram analisados estatisticamente.
Foi realizada análise de variância para verificar se
havia diferenças no ganho de peso dos animais entre o
início do experimento e o dia da cirurgia nos três grupos.
A seguir, aplicou-se o teste de comparações múltiplas
de Bonferroni para analisar as diferenças encontradas
entre os grupos.
Os mesmos testes estatísticos foram aplicados
para analisar o efeito das drogas sobre o peso dos animais,
no período entre o dia da cirurgia e o sacrifício,
comparando-se os diversos subgrupos. Os escores dos
indicadores histopatológicos das anastomoses nos subgrupos
sacrificados com o mesmo período de evolução pós-operatória
foram comparados utilizando-se o teste exato de Fisher.
Para estudar estatisticamente as variações
nas concentrações de hidroxiprolina entre subgrupos
de animais sacrificados com o mesmo período de
evolução pós-operatória, foram aplicados os testes
não-paramétricos de Kruskal- Wallis e de comparações múltiplas.
Em todos os testes, o nível de significância adotado
foi de 5%.
3 - RESULTADOS
3.1 - EVOLUÇÃO CLÍNICA DOS ANIMAIS
Um animal do grupo controle (C14-9), que deveria
ter sido sacrificado no décimo quarto dia, foi encontrado
morto na gaiola no sétimo dia pós-operatório.
A observação macroscópica da cavidade
abdominal desse animal não revelou sinais de deiscência
anastomótica, abscesso localizado ou peritonite
generalizada. Assim, a causa da morte foi classificada como
desconhecida.
Os demais ratos sobreviveram até as datas
estabelecidas para o sacrificio. Um animal do grupo
deflazacort (D7-5), apresentou apatia e diarréia após o
quinto dia da cirurgia, mas sobreviveu até a data
estabelecida para o sacrifício, (sétimo dia pós-operatório). A
reoperação, constatou-se que havia um abscesso
perianastomótico bloqueado.
Os animais restantes apresentaram boa evolução
pós-operatória, não sendo constatadas apatia, diarréia
ou distensão abdominal.
3.1.1 - AVALIAÇÃO DO PESO CORPORAL
As tabelas 1, 2 e 3 dos anexos exibem a distribuição
dos pesos dos animais nos diferentes subgrupos.
Na figura 5, verifica-se que as drogas
provocaram perdas significativas de peso nos animais durante
o período pré-operatório. Enquanto no grupo controle
os animais ganharam em média 14 gramas nos sete
dias entre o início do experimento e o dia da cirurgia,
no grupo deflazacort houve perda média de 17,8
gramas no peso corporal dos animais no mesmo período,
assim como perda média de 7,9 gramas na avaliação
ponderal dos animais do grupo prednisona, estabelecendo-se
uma diferença estatisticamente significante entre o
grupo controle e os grupos que receberam as drogas. A
perda de peso mais acentuada no grupo deflazacort
foi estatisticamente significante também em relação ao
grupo prednisona.
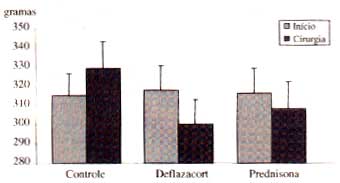 |
| Figura 5. Média dos pesos dos animais nos grupos Controle (n = 30), Deflazacort (n
= 30) e Prednisona (n = 30) no início do experimento e no dia da cirurgia. A
análise estatística mostrou diferenças significantes comparando-se os grupos Controle
vs Deflazacort (p < 0,05), Controle vs Prednisona (p < 0,05) e Deflazacort vs
Prednisona (p < 0,05).
|
Após a cirurgia, os animais sacrificados no terceiro
dia perderam peso. No subgrupo controle a perda média
de peso corporal foi de 17,4 gramas, no subgrupo
deflazacort a perda média foi de 20 gramas e no subgrupo
prednisona a perda média foi de 17,7 gramas. Não houve
diferenças estatisticamente significantes entre os três subgrupos
como mostra a figura 6.
Nos animais sacrificados no sétimo dia
pós-operatório, houve perda de peso
estatisticamente significante no subgrupo deflazacort (perda média
de 31,4 gramas), quando comparado com o subgrupo controle (perda média de 2,8 gramas). Não
houve diferença estatística significante comparando-se
os subgrupos controle com prednisona (perda média
de 19,6 gramas). Também não houve diferença
estatística significante entre os subgrupos deflazacort e
prednisona em relação à perda de peso dos animais
sacrificados no sétimo dia (figura 7).
 |
 |
| Figura 6. Distribuição ponderal dos animais nos
subgrupos Controle (C3),
Deflazacort (D3) e Prednisona (P3) no dia da cirurgia e no dia do sacrifício (terceiro dia
pós-operatório) com as respectivas médias. A análise estatística não mostrou
diferenças significantes entre os subgrupos.
|
Figura 7. Distribuição ponderal dos animais nos subgrupos Controle (C3),
Deflazacort (D3) e Prednisona (P3) no dia da cirurgia e no dia do sacrifício (sétimo dia
pós-operatório) com as respectivas médias. A análise estatística mostrou diferença
significante entre os subgrupos C7 vs D7 (p < 0,05).
|
No décimo quarto dia pós-operatório, os animais
dos subgrupos deflazacort e prednisona continuaram
perdendo peso (respectivamente perda média de 13,2 gramas e
2,7 gramas), não havendo diferença estatística significante
entre os dois subgrupos. Todavia, os animais do subgrupo
controle ganharam em média 16,2 gramas de peso corporal.
A comparação entre o ganho de peso do subgrupo controle
e os demais subgrupos resultou numa diferença
estatística significante no décimo quarto dia pós-operatório (figura 8).
 |
| Figura 8. Distribuição ponderal dos animais nos subgrupos Controle (CI4),
Deflazacort (D 14) e Prednisona (P 14) no dia da cirurgia e no dia do sacrifício (décimo quarto
dia pós-operatório) com as respectivas médias. A análise estatística mostrou
diferenças significantes na comparação entre os subgrupos C14 vs D14 (p < 0,05) e C14 vs P14
(p < 0,05).
|
3.1.2 - ESTUDO DA CAVIDADE ABDOMINAL
A observação macroscópica da cavidade abdominal
à reoperação não revelou sinais de deiscências
anastomóticas. Nenhum animal apresentou peritonite generalizada.
Havia aderências firmes, entre as anastomoses e
alças intestinais, gordura e vesículas seminais em animais
de todos os subgrupos (tabela 1). Entretanto, após
desfeitas as aderências, não foram observadas
deiscências macroscópicas.
Porém, o animal D7-5, do grupo deflazacort,
sacrificado no sétimo dia pós-operatório, apresentou
abscesso perianastomótico, bloqueado por alças intestinais e
gordura. Ao manusear-se o segmento intestinal para
liberação das aderências, ocorreu o rompimento da sutura,
impossibilitando-se assim a realização da histopatologia e do
estudo bioquímico da anastomose desse animal.
Tabela 1.
Presença de aderências firmes perianastomóticas nos diversos grupos em relação ao dia do sacrifício
| |
Terceiro dia |
Sétimo dia |
Décimo quarto dia |
| Grupo Controle |
5 animais |
3 animais |
4 animais |
| Grupo Deflazacort |
3 animais |
3 animais |
3 animais |
| Grupo Prednisona |
4 animais |
2 animais |
4 animais |
3.2 - AVALIAÇÃO HISTOPATOLÓGICA
Os resultados da avaliação histopatológica
estão demonstrados de forma comparativa entre os
subgrupos de animais sacrificados no mesmo dia de evolução
pós-operatória nas tabelas 2, 3 e 4.
As microfotografias das figuras 9 a 17 e as tabelas 4
a 12 dos anexos ilustram os achados histopatológicos.
Tabela 2.
Influência das drogas sobre os indicadores histopatológicos do processo cicatricial nas anastomoses intestinais
dos animais sacrificados no terceiro dia após a cirurgia
| |
Subgrupo Controle (C3)
|
Subgrupo Def1azacort (D3)
|
Subgrupo Prednisona (P3)
|
| |
n=10
|
n=10
|
n=10
|
| |
( ) |
(+) |
(++) |
(+++) |
( ) |
(+) |
(++) |
(+++) |
( ) |
(+) |
(++) |
(+++) |
| Crosta fibrino leucocitária |
0 |
2 |
3 |
5 |
1 |
2 |
4 |
3 |
0 |
4 |
2 |
4 |
| Necrose focal |
0 |
2 |
3 |
5 |
1 |
2 |
4 |
3 |
0 |
4 |
2 |
4 |
| Depósitos de fibrina |
0 |
2 |
3 |
5 |
1 |
2 |
4 |
3 |
0 |
4 |
2 |
4 |
| Exsudato neutrofilico * |
0 |
0 |
4 |
6 |
0 |
7 |
3 |
0 |
1 |
6 |
3 |
0 |
| Edema |
0 |
2 |
5 |
3 |
0 |
7 |
3 |
0 |
0 |
6 |
3 |
1 |
| Dilatação linfática |
0 |
5 |
3 |
2 |
2 |
6 |
2 |
0 |
0 |
6 |
3 |
1 |
| Congestão vascular |
0 |
2 |
6 |
2 |
1 |
6 |
2 |
1 |
0 |
7 |
2 |
1 |
| Hemorragia focal |
1 |
4 |
5 |
0 |
1 |
5 |
4 |
0 |
2 |
5 |
3 |
0 |
| Exsudato eosinofilico * |
0 |
0 |
6 |
4 |
1 |
6 |
3 |
0 |
0 |
7 |
3 |
0 |
| Regeneração mucosa |
9 |
1 |
0 |
0 |
10 |
0 |
0 |
0 |
9 |
1 |
0 |
0 |
| Infiltrado mononuclear * |
0 |
9 |
1 |
0 |
5 |
5 |
0 |
0 |
6 |
4 |
0 |
0 |
| Infiltração macrofágica * |
0 |
9 |
1 |
0 |
5 |
5 |
0 |
0 |
6 |
4 |
0 |
0 |
| Granulomas |
10 |
0 |
0 |
0 |
10 |
0 |
0 |
0 |
10 |
0 |
0 |
0 |
| Neoformação vascular |
8 |
2 |
0 |
0 |
7 |
3 |
0 |
0 |
6 |
4 |
0 |
0 |
| Proliferação fibroblástica * |
0 |
4 |
6 |
0 |
6 |
4 |
0 |
0 |
5 |
5 |
0 |
0 |
| Fibrose |
3 |
7 |
0 |
0 |
6 |
4 |
0 |
0 |
5 |
5 |
0 |
0 |
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
* p < 0,05 (teste exato de Fisher)
|
Tabela 3.
Influência das drogas sobre os indicadores histopatológicos do processo cicatricial nas anastomoses intestinais
dos animais sacrificados no sétimo dia após a cirurgia
| |
Subgrupo Controle
(C7)
|
Subgrupo Def1azacort
(D7)
|
Subgrupo Prednisona
(P7)
|
| |
n=10
|
n=9 |
n=10
|
| |
( ) |
(+) |
(++) |
(+++) |
( ) |
(+) |
(++) |
(+++) |
( ) |
(+) |
(++) |
(+++) |
| Crosta fibrino leucocitária |
6 |
2 |
2 |
0 |
3 |
3 |
2 |
1 |
6 |
3 |
1 |
0 |
| Necrose focal |
6 |
2 |
2 |
0 |
3 |
3 |
2 |
1 |
6 |
3 |
1 |
0 |
| Depósitos de fibrina |
6 |
2 |
2 |
0 |
3 |
3 |
2 |
1 |
6 |
3 |
1 |
0 |
| Exsudato neutrofilico * |
1 |
9 |
0 |
0 |
5 |
4 |
0 |
0 |
7 |
3 |
0 |
0 |
| Edema |
0 |
8 |
2 |
0 |
1 |
6 |
2 |
0 |
3 |
6 |
1 |
0 |
| Dilatação linfática |
7 |
3 |
0 |
0 |
5 |
4 |
0 |
0 |
4 |
6 |
0 |
0 |
| Congestão vascular |
1 |
6 |
3 |
0 |
0 |
8 |
1 |
0 |
1 |
9 |
0 |
0 |
| Hemorragia focal |
9 |
1 |
0 |
0 |
8 |
1 |
0 |
0 |
9 |
1 |
0 |
0 |
| Exsudato eosinofilico |
0 |
5 |
5 |
0 |
0 |
8 |
1 |
0 |
1 |
8 |
1 |
0 |
| Regeneração mucosa |
0 |
4 |
5 |
1 |
0 |
5 |
3 |
1 |
0 |
5 |
5 |
0 |
| Infiltrado mononuclear |
0 |
2 |
7 |
1 |
0 |
6 |
3 |
0 |
0 |
7 |
3 |
0 |
| Infiltração macrofágica |
0 |
3 |
6 |
1 |
0 |
6 |
3 |
0 |
0 |
7 |
3 |
0 |
| Granulomas |
4 |
5 |
0 |
1 |
7 |
2 |
0 |
0 |
6 |
3 |
1 |
0 |
| Neoformação vascular |
0 |
0 |
9 |
1 |
0 |
1 |
8 |
0 |
0 |
0 |
10 |
0 |
| Proliferação fibroblástica * |
0 |
0 |
5 |
5 |
0 |
1 |
8 |
0 |
0 |
1 |
8 |
1 |
| Fibrose |
0 |
0 |
9 |
1 |
0 |
2 |
7 |
0 |
0 |
2 |
7 |
1 |
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
* p < 0,05 (teste exato de Fisher)
Tabela 4.
Influência das drogas sobre os indicadores histopatológicos do processo cicatricial nas anastomoses intestinais
dos animais sacrificados no décimo quarto dia após a cirurgia
|
| |
Subgrupo Controle
(C14)
|
Subgrupo Def1azacort
(D14)
|
Subgrupo Prednisona
(P14)
|
| |
n=9 |
n=10
|
n=10
|
| |
( ) |
(+) |
(++) |
(+++) |
( ) |
(+) |
(++) |
(+++) |
( ) |
(+) |
(++) |
(+++) |
| Crosta fibrino leucocitária |
9 |
0 |
0 |
0 |
8 |
2 |
0 |
0 |
10 |
0 |
0 |
0 |
| Necrose focal |
9 |
0 |
0 |
0 |
8 |
2 |
0 |
0 |
10 |
0 |
0 |
0 |
| Depósitos de fibrina |
9 |
0 |
0 |
0 |
8 |
2 |
0 |
0 |
10 |
0 |
0 |
0 |
| Exsudato neutrofilico |
9 |
0 |
0 |
0 |
10 |
0 |
0 |
0 |
10 |
0 |
0 |
0 |
| Edema |
8 |
1 |
0 |
0 |
7 |
2 |
1 |
0 |
8 |
1 |
1 |
0 |
| Dilatação linfática |
8 |
1 |
0 |
0 |
8 |
2 |
0 |
0 |
8 |
2 |
0 |
0 |
| Congestão vascular |
5 |
4 |
0 |
0 |
4 |
6 |
0 |
0 |
6 |
4 |
0 |
0 |
| Hemorragia focal |
8 |
1 |
0 |
0 |
10 |
0 |
0 |
0 |
10 |
0 |
0 |
0 |
| Exsudato eosinofilico |
4 |
5 |
0 |
0 |
4 |
5 |
1 |
0 |
5 |
4 |
1 |
0 |
| Regeneração mucosa |
0 |
0 |
4 |
5 |
0 |
0 |
6 |
4 |
0 |
0 |
4 |
6 |
| Infiltrado mononuclear |
0 |
6 |
3 |
0 |
0 |
6 |
4 |
0 |
0 |
8 |
2 |
0 |
| Infiltração macrofágica |
0 |
6 |
3 |
0 |
0 |
6 |
4 |
0 |
0 |
8 |
2 |
0 |
| Granulomas |
7 |
1 |
0 |
1 |
6 |
3 |
1 |
0 |
8 |
1 |
1 |
1 |
| Neoformação vascular |
0 |
1 |
5 |
3 |
0 |
2 |
6 |
2 |
0 |
4 |
4 |
2 |
| Proliferação fibroblástica |
0 |
4 |
4 |
1 |
0 |
5 |
5 |
0 |
0 |
6 |
3 |
1 |
| Fibrose |
0 |
0 |
4 |
5 |
0 |
0 |
6 |
4 |
0 |
0 |
5 |
5 |
|
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
|
 |
 |
|
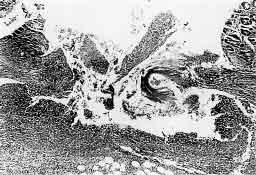
Figura 9. Aspecto microscópico da anastomose colônica no terceiro dia pós-
operatório no animal C3-6 do subgrupo controle (hematoxilina-eosina; 90 X).
|
Figura 10. Aspecto microscópico da anastomose colônica no terceiro dia pós-
operatório no animal D3-2 do subgrupo deflazacort (hematoxilina-eosina; 90 X).
|
 |
 |
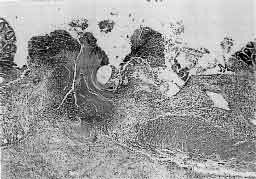
| Figura 11. Aspecto microscópico da anastomose colônica no terceiro dia pós-
operatório no animal P3-4 do subgrupo prednisona (hematoxilina-eosina; 90 X).
|
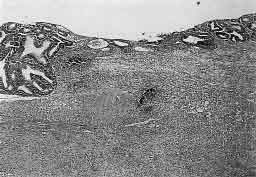
Figura 12. Aspecto microscópico da anastomose colônica no sétimo dia pós-
operatório no animal C7 -5 do subgrupo controle (hematoxilina-eosina; 90 X).
|
 |
 |
|
Figura 13. Aspecto microscópico da anastomose colônica no sétimo dia pós-
operatório no animal D7-3 do subgrupo deflazacort (hematoxilina-eosina; 90 X).
|
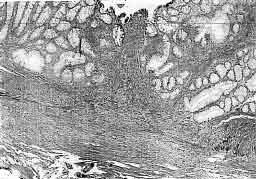
Figura 14. Aspecto microscópico da anastomose colônica no sétimo dia pós-
operatório no animal P7-2 do subgrupo prednisona (hematoxilina-eosina; 90 X).
|
 |
 |
 |
| Figura 15. Aspecto microscópico da anastomose colônica no décimo quarto dia
pós-operatório no animal C14-5 do subgrupo controle (tricrômico de
Masson; 90 X).
|
Figura 16. Aspecto microscópico da anastomose colônica no décimo quarto dia:
pós-operatório no animal D14-5 do subgrupo deflazacort (tricrômico de
Masson; 90 X).
|
Figura 17. Aspecto microscópico da anastomose colônica no décimo quarto dia
pós-operatório no animal P14-6 do subgrupo prednisona (tricrômico de
Masson; 90 X).
|
3.2.1 - ANIMAIS SACRIFICADOS NO TERCEIRO DIA PÓS-OPERATÓRIO
Na avaliação histopatológica do processo cicatricial
em anastomoses intestinais dos subgrupos C3, D3 e
P3, observaram-se diferenças estatisticamente
significativas para os indicadores: exsudato neutrofílico,
exsudato eosinofílico, infiltrado mononuclear, infiltração
macrofágica e proliferação fibroblástica. Todos esses indicadores
foram mais exuberantes no subgrupo controle.
3.2.2 - ANIMAIS SACRIFICADOS NO SÉTIMO
DIA PÓS-OPERATÓRIO
Na avaliação histopatológica do processo cicatricial
em anastomoses intestinais dos subgrupos C7, D7 e
P7, observaram-se diferenças estatisticamente
significativas para os indicadores: exsudato neutrofílico e
proliferação fibroblástica, que se apresentavam mais intensos
no subgrupo controle.
3.2.3 -ANIMAIS SACRIFICADOS NO DÉCIMO QUARTO DIA PÓS-OPERATÓRIO
Não houve diferenças estatisticamente
significativas nos indicadores da avaliação histopatológica do
processo cicatricial nas anastomoses intestinais dos subgrupos
C14, D14 e P14.
3.3 -ANÁLISE BIOQUÍMICA
3.3.1 - ANIMAIS SACRIFICADOS NO TERCEIRO DIA PÓS-OPERATÓRIO
Com a aplicação do teste não-paramétrico
de Kruskal-Wallis, para comparação das concentrações
de hidroxiprolina nos subgrupos de animais
sacrificados no terceiro dia pós-operatório,
demonstraram-se diferenças estatisticamente significativas entre
os subgrupos.
Com a aplicação do teste não-paramétrico
de comparações múltiplas verificou-se que a
concentração tecidual de hidroxiprolina foi menor no
subgrupo prednisona, quando comparada tanto com o
subgrupo controle, quanto com o subgrupo deflazacort (tabela 5
e figura 18).
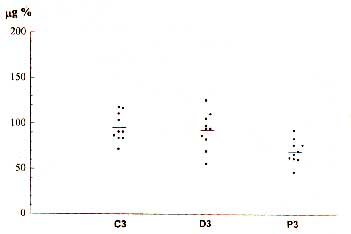
Tabela 5.
Concentração de hidroxiprolina em microgramas
para cada 100 miligramas de tecido seco nos subgrupos
de animais sacrificados no terceiro dia pós-operatório
| Número do animal |
Controle |
Deflazacort |
Prednisona |
| |
C3 |
D3 |
P3 |
| 1 |
118 |
70 |
70 |
| 2 |
117 |
126 |
61 |
| 3 |
84 |
106 |
93 |
| 4 |
104 |
98 |
47 |
| 5 |
111 |
56 |
84 |
| 6 |
72 |
95 |
77 |
| 7 |
91 |
87 |
67 |
| 8 |
84 |
111 |
62 |
| 9 |
91 |
83 |
63 |
| 10 |
87 |
95 |
77 |
| Média
|
95,9
|
92,7
|
70,1
|
|
|
| Figura 18. Concentração de hidroxiprolina em microgramas para cada cem
miligramas de tecido seco das anastomoses dos animais sacrificados no terceiro dia
pós-operatório nos subgrupos Controle (C3), Deflazacort (D3) e Prednisona (P3) com as
respectivas médias. A análise estatística mostrou diferenças significantes entre C3 vs P3 (p <
0,05) e D3 vs P3 (p < 0,05).
|
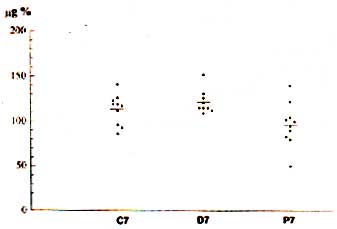
3.3.2 - ANIMAIS SACRIFICADOS NO SÉTIMO
DIA PÓS-OPERATÓRIO
Com a aplicação do teste não-paramétrico de
Kruskal-Wallis, para comparação das concentrações de
hidroxiprolina nos subgrupos de animais sacrificados no
sétimo dia pós-operatório, demonstraram-se diferenças
estatisticamente significativas entre os subgrupos.
Com a aplicação do teste não-paramétrico
de comparações múltiplas verificou-se que a
concentração tecidual de hidroxiprolina era menor no subgrupo
prednisona do que no subgrupo deflazacort. Entretanto, não
houve diferença estatisticamente significante entre os
subgrupos que receberam as drogas e o subgrupo controle (tabela 6
e figura 19).
Tabela 6.
Concentração de hidroxiprolina em microgramas
para cada 100 miligramas de tecido seco nos subgrupos
de animais sacrificados no sétimo dia pós-operatório
| Número do animal |
Controle |
Deflazacort |
Prednisona |
| |
C7 |
D7 |
P7 |
| 1 |
126 |
152 |
83 |
| 2 |
86 |
115 |
50 |
| 3 |
112 |
115 |
80 |
| 4 |
119 |
131 |
105 |
| 5 |
93 |
* |
95 |
| 6 |
141 |
115 |
90 |
| 7 |
96 |
121 |
100 |
| 8 |
117 |
112 |
122 |
| 9 |
119 |
126 |
140 |
| 10 |
123 |
109 |
102 |
| Média
|
113,2
|
121,7
|
96,7
|
|
* anulado devido a abscesso perianastomótico
|
|
|
| Figura 19. Concentração de hidroxiprolina em microgramas para cada
cem miligramas de tecido seco das anastomoses dos animais sacrificados no sétimo
dia pós-operatório nos subgrupos Controle (C7), Deflazacort (D7) e Prednisona
(P7) com as respectivas médias. A análise estatística mostrou diferença significante
entre D7 vs P7 (p < 0,05).
|
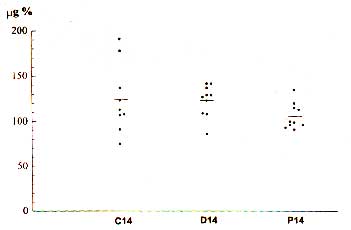
3.3.3 - ANIMAIS SACRIFICADOS NO DECIMO QUARTO DIA PÓS-OPERATÓRIO
Nos subgrupos de animais sacrificados no décimo
quarto dia pós- operatório não houve diferenças
estatisticamente significativas, quando se compararam as
concentrações teciduais de hidroxiprolina pelo teste não paramétrico
de Kruskal-Wallis (tabela 7 e figura 20).
Tabela 7.
Concentração de hidroxiprolina em microgramas
para cada 100 miligramas de tecido seco nos subgrupos
de animais sacrificados no décimo quarto dia pós-operatório
| Número do animal |
Controle |
Deflazacort |
Prednisona |
| |
C14 |
D14 |
P14 |
| 1 |
113 |
142 |
91 |
| 2 |
123 |
129 |
113 |
| 3 |
191 |
123 |
99 |
| 4 |
91 |
142 |
135 |
| 5 |
107 |
127 |
96 |
| 6 |
75 |
108 |
96 |
| 7 |
108 |
86 |
115 |
| 8 |
137 |
129 |
93 |
| 9 |
* |
137 |
100 |
| 10 |
178 |
109 |
120 |
| Média
|
124,7
|
123,2
|
105,8
|
* óbito
|
|
| Figura 20. Concentração de hidroxipro1ina em microgramas para cada cem
miligramas de tecido seco das anastomoses dos animais sacrificados no décimo quarto dia
pós-operatório nos subgrupos Controle (C14), Deflazacort (D14) e Prednisona (P14)
com as respectivas médias. A análise estatística não mostrou diferenças significantes entre
os subgrupos.
|
4 - DISCUSSÃO
Na presente investigação foram estudados os efeitos
de dois glicocorticóides sintéticos, a prednisona e o
deflazacort, na cicatrização de anastomoses no intestino grosso de
ratos. Os parâmetros avaliados foram: evolução clínica
dos animais, peso corporal, aspectos da cavidade
abdominal, achados macro e microscópicos das anastomoses
e concentração tecidual de hidroxiprolina.
Em muitos estudos têm-se evidenciado que o
deflazacort é tão eficaz quanto a prednisona na terapêutica de
várias doenças como polimialgia reumática (LUND
et al., 1987; GRAY et al., 1991), lupo eritematoso
sistêmico (SCUDELETTI et al., 1993), sarcoidose
crônica (RIZZATO et al., 1997), artrite reumatóide (GRAY
et al., 1991; MESSINA et al., 1992; SCUDELETTI
et al., 1993), artrite crônica (ou reumatóide) juvenil (LOFTUS
et al., 1991), doenças hematológicas linfoproliferativas ou
auto-imunes (GOBBI & SCUDELETTI, 1993),
síndrome nefrótica idiopática (BROYER
et al., 1997) e no controle de pacientes que receberam transplantes de
órgãos (ARIZÓN et al.,
1993; KIM et al., 1997; LIPPUNER et al.,
1998).
Apesar da utilização clínica da prednisona e
do deflazacort, não há na literatura estudos comparativos
entre as duas drogas no tratamento das doenças
inflamatórias intestinais, assim como também não há
estudos comparativos sobre os possíveis efeitos dessas drogas
na cicatrização de anastomoses intestinais.
Por apresentar menos efeitos colaterais indesejáveis
do que a prednisona em doses antiinflamatórias
equivalentes, o deflazacort, no entender de MARKHAM &
BRYSON (1995), pelo menos em crianças, deveria ser
considerado como opção inicial nos casos que necessitassem de
terapia com corticosteróides, uma vez que os efeitos
deletérios causados por essa classe de drogas são especialmente
graves nesse grupo de pacientes.
Diversos autores têm escolhido o rato como animal
de experimentação .para o estudo de anastomoses
intestinais (CRONIN et al., 1968a; CRONIN
et al.,1968b; JIBORN et al., 1978b; JIBORN
et al., 1978c; HbGSTRbM & HAGLUND, 1985; LEITE
et al., 1993; NARESSE et al., 1993 ; OLIVEIRA
et al., 1994; OLIVEIRA, 1995; SOARES, 1996; REGAZZINI, 1996). Tal escolha
deve-se ao fato de o rato ser de fácil padronização quanto
à raça, sexo e peso, além de ser resistente às
infecções, dispensando a adoção de técnica cirúrgica asséptica.
Entre outras vantagens, o rato também apresenta baixo custo
e facilidade de manutenção no biotério.
Alguns pesquisadores têm confeccionado as
anastomoses colônicas em murídeos com pontos separados
invertidos, em plano único, sem que ocorram muitas
complicações (HOUSTON & ROTSTEIN, 1988; CALI
et al., 1993; FURST et al., 1994; DEL RIO
et al., 1996; EUBANKS et al., 1997).
No entanto, há relatos em que se obtiveram
excelentes resultados com anastomoses colônicas em ratos
empregando-se sutura contínua em plano único (HERRMANN
et al., 1964; CRONIN et al., 1968a; CRONIN
et al.,1968b; HOUDART et al., 1985). Esse método tem a vantagem
de ser simples, rápido e econômico, promovendo
impermea-bilidade e pouca reação inflamatória tecidual, o que o
torna tão seguro quanto aquele realizado em um plano com
pontos separados (KISS et al., 1976; BAILEY
et al., 1981; BAILEY et al., 1984; HARDER & VOGELBACH,
1988; SKAKUN et al., 1988; ROCHA, 1989).
A confecção das anastomoses com sutura contínua
em plano único mostrou-se eficaz também no presente
trabalho, sobretudo porque utilizou-se fio
monofilamentar (polipropileno 6-0) para a confecção das
anastomoses colônicas. O cuidado técnico na escolha do material
é necessário, porque os fios multifilamentados
podem favorecer o surgimento de infecção pelo aumento
da aderência bacteriana aos componentes
trançados, aumentando, por conseguinte, a reação
inflamatória, alterando os resultados obtidos (KATZ
et al., 1981). Os fios monofilamentados, tanto absorvíveis
(polidioxanona ou poliglecaprone), quanto não-absorvíveis
(polipropileno ou náilon), devem ser os preferidos para as suturas
manuais na cirurgia intestinal (KHOURY & WAXMAN, 1983).
É importante a especificação do local das
anastomoses, uma vez que podem ocorrer diferenças de cicatrização
ao longo do trato digestivo. No .intestino grosso do rato,
além dos aspectos histológicos serem diversificados
(LINDSTROM et al., 1979), a concentração e o metabolismo do
colágeno mostram-se variáveis nos diferentes segmentos (JIBORN
et al., 1978a; JIBORN et al., 1980). Nos coelhos, a atividade
da colagenase varia ao longo do trato gastrintestinal
após anastomoses colônicas (HA WLEY
et al., 1970b ). Tendo em vista esses estudos prévios, as ressecções e
anastomoses foram realizadas em segmento colônico distal,
padronizado pela distância fixa em relação à reflexão peritoneal, para
que não ocorressem erros de interpretação dos resultados.
De acordo com o peso corporal dos animais,
utilizaram-se doses equivalentes de deflazacort e prednisona para
a mesma potência antiinflamatória e dentro dos
limites considerados clínicos. A proporção utilizada foi de 1 mg
de prednisona para 1,2 mg de deflazacort, doses
consideradas terapeuticamente equivalentes em outras pesquisas
(LUND et al., 1987; GRA Y et al., 1991; KIM
et al., 1997). As drogas foram ministradas até o dia do sacrifício dos
animais e nas mesmas dosagens do período pré-operatório, para
que se mantivessem os níveis plasmáticos de cortisol, uma
vez que níveis subfisiológicos poderiam também prejudicar
a cicatrização (MATSUSUE & WALSER, 1992).
É intrigante notar que EUBANKS et al.
(1997), mesmo tendo reconhecido que usaram dosagens excessivas
de dexametasona, hidrocortisona ou .metilprednisolona
para estudar a cicatrização de anastomoses colônicas em
ratos, não encontraram alterações nas anastomoses,
quando comparadas com o grupo controle, não tendo
havido deiscências ou óbitos entre seus animais. Por outro
lado, há pesquisadores que, utilizando doses de
corticosteróides relativamene bem menores, demonstraram efeitos
deletérios na cicatrização das anastomoses colônicas de
coelhos, porém sem terem ocorrido deiscências
anastomóticas (PHILLIPS et al., 1992; KIM
et al., 1993).
A taxa de mortalidade em animais tratados com corticosteróides e submetidos a anastomoses colônicas
tem variado de 0 a 11,4%, embora os óbitos não tenham
ocorrido por deiscências anastomóticas (MASTBOOM
et al., 1991b; PHILLIPS et al., 1992; CALI
et al., 1993; KIM et al., 1993; FURST
et al., 1994; DEL RIO et al., 1996; EUBANKS
et al., 1997; SIRIMARCO et al.,
1999). Somente no estudo de HOUSTON & ROTSTEIN
(1988) ocorreram óbitos devido a peritonite, mas nem todos
os ratos apresentavam deiscência da sutura intestinal.
Infere-se que o rato oferece condições para
ressecções e anastomoses colônicas seguras, apesar de seu
pequeno tamanho, pois também no presente trabalho a taxa
de mortalidade geral foi baixa (1,11 %). Apenas um
animal, pertencente ao grupo controle, foi encontrado morto
no sétimo dia, quando deveria ter sido sacrificado no
décimo quarto dia. Não havia sinais de deiscências
anastomóticas ou peritonite, sendo desconhecida a causa da morte.
A taxa de mortalidade foi zero, portanto idêntica, entre
os grupos deflazacort e prednisona, pois todos os animais
que receberam os corticosteróides sobreviveram até as
datas estabelecidas para o sacrifício.
No período pré-operatório, os
corticosteróides deflazacort e prednisona provocaram perda de
peso corporal nos ratos, quando comparados com os animais
do grupo controle. No grupo deflazacort, a perda de peso
foi ainda mais acentuada do que no grupo prednisona,
com diferença estatisticamente significativa entre os dois
grupos que receberam corticosteróides. ASZODI &
PONSKY (1984), estudando os efeitos da hidrocortisona sobre
a cicatrização de anastomoses do intestino delgado de
ratos, observaram que, no período pré-operatório de
quatorze dias, a perda de peso era significativa e que, quanto
maior a dose do corticosteróide, maior era a perda ponderal
dos ratos. Apesar da continuidade da corticoterapia até o
dia do sacrifício (quatro, cinco, sete e dez dias), os
autores não se referiram à variação de peso no pós-operatório.
Por outro lado, MASTBOOM et al. (199lb),
estudando a influência da metilprednisolona sobre a cicatrização
de anastomoses intestinais em ratos, não se referiram à
variação do peso no período pré-operatório, mesmo iniciando a
terapia com o corticosteróide dois dias antes da cirurgia. Os
autores mantiveram a droga até a data do sacrificio (três e sete
dias após o ato cirúrgico), mas não encontraram diferenças
nas alterações de peso entre os grupos no período
pós- operatório: tanto o grupo teste, quanto o grupo
controle, apresentaram perda de peso entre o segundo e o quarto
dia após a cirurgia. No sétimo dia pós-operatório, os
ratos alcançaram os níveis ponderais do período pré-operatório.
Na presente pesquisa, os ratos de todos os
subgrupos sacrificados no terceiro dia pós-operatório também
perderam peso, não havendo diferenças estatisticamente
significativas entre os subgrupos controle, deflazacort e prednisona.
No sétimo dia pós-operatório, os ratos do
subgrupo deflazacort foram os mais prejudicados quanto à perda
de peso, pois houve uma diferença estatisticamente
significativa entre o subgrupo deflazacort e o subgrupo controle. Não
houve diferença estatística entre os subgrupos controle e
prednisona, assim como entre os subgrupos deflazacort e prednisona.
Todavia, no décimo quarto dia pós-operatório,
enquanto os animais do subgrupo controle ganhavam peso, os
ratos dos subgrupos que receberam corticosteróides
perdiam peso, resultando numa diferença estatística significante,
sem que houvesse diferença estatística entre os
subgrupos deflazacort e prednisona.
A perda de peso poderia significar um risco
às anastomoses colônicas, .pois refletiria um estado
catabólico dos ratos, podendo levar à depleção proteica,
com diminuição do colágeno visceral (DAL Y
et al., 1972; IRVIN & HUNT, 1974). Todavia, na presente
pesquisa, a perda de peso não foi significativa a ponto de se
refletir em complicações na cicatrização das
anastomoses colônicas dos ratos, pois não houve deiscências
das suturas. De fato, IRVIN (1978), estudando ratos
mal nutridos, observou que alterações significativas
na cicatrização de feridas ocorriam somente na presença
de desnutrição grave, quando a perda ponderal excedia
um terço do peso corporal normal. No mesmo estudo, o
autor demonstrou ainda que a má nutrição de ratos
afetava menos a cicatrização do cólon do que outros tecidos.
Os métodos frequentemente utilizados para estudo
das anastomoses intestinais têm sido mecânicos,
bioquímicos e histológicos.
Dentre os parâmetros mecânicos, a medida da
pressão de ruptura da anastomose tem sido muito empregada.
A avaliação é feita em um segmento intestinal que contém
a anastomose no centro e, após adequadamente
fechada uma das extremidades, pela outra injeta-se um líquido
ou um gás até que ocorra a ruptura. Mais comumente
a distensão da alça é feita por ar atmosférico, insuflado
a fluxo constante, e a pressão em que ocorre a ruptura
é medida por manômetro de mercúrio ou por fisiógrafo.
O método pode ser aplicado com o animal vivo,
anestesiado, em segmento intestinal viável, com ou sem liberação
das aderências peritoneais ou em segmento
ressecado. Obviamente, os valores de pressão de ruptura
encontrados podem variar consideravelmente, gerando
resultados dubitáveis (APRILLI et al.,
1998).
Alguns autores demonstraram diminuição da
pressão de ruptura nas anastomoses intestinais em animais
sob efeito de corticosteróides, estimando-se então que
os corticosteróides prejudicariam a cicatrização
(HOUSTON & ROTSTEIN, 1988; PHILLIPS et al.,
1992; KIM et al., 1993; FURST et al.,
1994; DEL RIO et al., 1996). Porém, EUBANKS
et al. (1997) não observaram diferenças nas pressões de rupturas em
anastomoses colônicas, mesmo submetendo os ratos a altas doses
de três diferentes corticosteróides. MASTBOOM
et al. (1991b) também não encontraram diferenças no
terceiro dia pós-operatório, sendo que no sétimo dia, as
pressões de ruptura das anastomoses colônicas foram maiores
nos grupos tratados do que no grupo controle,
concluindo que a cicatrização de anastomoses colônicas em
ratos não foi afetada pela administração de
metilprednisolona a curto prazo.
Controvérsias existem sobre a utilidade do método
de pressão de ruptura para avaliação de anastomoses
intestinais. HENDRIKS & MASTBOOM (1990) acreditam que
a pressão de ruptura seja um bom método para estudo
da cicatrização de anastomoses somente quando a ruptura
se dá no local da anastomose e o teste for realizado
nos primeiros dias após a cirurgia, quando a
resistência anastomótica é baixa e as chances para deiscências
são relativamente altas.
Pode haver subestimação do valor real da
resistência da anastomose, quando o ponto de ruptura ocorre fora
da sutura. O fator limitante à medida da pressão de
ruptura (ou resistência à insuflação) de anastomoses intestinais é
a diferença entre o raio menor no local da sutura e o
raio maior no segmento intestinal contíguo. Uma vez que
a tensão dentro de um segmento intestinal é semelhante à
de um cilindro, ao aplicar-se a Lei de Laplace, em que a
tensão circular é o produto da pressão pelo raio, a
anastomose intestinal torna-se mais resistente à ruptura do que
o segmento intestinal adjacente intacto (NELSEN
& ANDERS, 1966).
Categoricamente, RAVITCH et al. (1981)
afirmaram que as pressões de ruptura, apresentadas em
vários experimentos em valores tão mais altos do que os
níveis clínicos, deixam dúvidas quanto à eficácia dos
parâmetros mecânicos como avaliação de cicatrização de
anastomoses. Assim, decidiu-se não utilizar métodos mecânicos
no presente estudo.
A quantificação do colágeno é um dos métodos
de avaliação bioquímica da evolução cicatricial
de anastomoses (CRONIN et al, 1968a; CRONIN
et al, 1968b). O fibroblasto sintetiza mucopo1issacarídeos
e colágeno. Por sua vez, o colágeno, proteína presente
na matriz extrace1u1ar, tem sido considerada a
substância responsável pela resistência mecânica da
cicatriz (HENDRIKS & MASTBOOM, 1990). A hidroxilação
da prolina e da 1isina, aminoácidos vitais na síntese
do colágeno, ocorre na presença de oxigênio, ácido
ascórbico, ferro iônico, cetoglutarato e zinco, que podem
prejudicar a síntese do colágeno quando estiverem
deficientes (FORREST, 1983; RAVO, 1988). Com a
modificação bioquímica da prolina, o colágeno passa a ter em
suas cadeias um aminoácido exclusivo que é a
hidroxiprolina, compreendendo aproximadamente um terço
dos aminoácidos da proteína (WISE
et al., 1975; BALLANTYNE, 1983). A mensuração da
hidroxipro1ina torna-se então uma estimativa do colágeno e, por
isso, tem sido usada como um parâmetro bioquímico
de avaliação cicatricial. Pela análise da concentração
tecidual de hidroxiprolina, em tecido seco, houve
diferenças estatisticamente significantes nas anastomoses
dos subgrupos de animais sacrificados no terceiro dia
pós-operatório. A concentração tecidual de hidroxiprolina
foi menor no subgrupo prednisona, quando comparada
tanto com o subgrupo controle, quanto com o
subgrupo deflazacort.
Nos animais sacrificados no sétimo dia
pós-operatório, o subgrupo prednisona também apresentou
menor concentração tecidual de hidroxiprolina nas
anastomoses em relação ao subgrupo deflazacort. Porém, não
houve diferenças estatisticamente significantes em relação
ao subgrupo controle.
No décimo quarto dia pós-operatório, não
houve diferenças estatisticamente significantes entre os
diversos subgrupos de animais em relação à concentração
tecidual de hidroxiprolina.
Nos primeiros dias de cicatrização, nos animais
tratados com o deflazacort não se observou diminuição
nas concentrações teciduais de hidroxiprolina, como
ocorreu com os animais tratados com a prednisona. Portanto,
o deflazacort foi vantajoso em relação à prednisona
no estudo bioquímico, sobretudo porque, além
de compreender aproximadamente um terço dos
aminoácidos da proteína, a hidroxiprolina é o aminoácido que
confere estabilidade na conformação da tríplice hélice do
colágeno (MILLER, 1976; PEREZ-TAMAYO, 1978;
FORREST, 1983; PROCKOP & KIVlRIKKO, 1995). O
melhor desempenho do deflazacort torna-se mais evidente
porque não houve diferença estatisticamente significante entre
os animais que receberam essa droga e os animais do
grupo controle em relação à concentração tecidual
de hidroxiprolina em qualquer fase. Em outro
estudo (SIRIMARCO, 1998; SIRIMARCO et al., 1999),
quando foram confeccionadas anastomoses colônicas em
ratos com pontos separados, o deflazacort também não
alterou a concentração tecidual de hidroxiprolina,
comparando-se com o grupo controle. Esses resultados se
assemelham aos de MASTBOOM et al. (1991b) que, analisando
o conteúdo de hidroxiprolina em anastomoses colônicas
de ratos, sob ação da metilprednisolona, também
não encontraram diferenças em relação ao grupo controle
e, mesmo quando a dose era elevada (10 mg/kg/dia),
não houve deiscências. Porém, os autores sacrificaram os
ratos no terceiro e sétimo dias após as cirurgias, deixando
de analisar a cicatrização em uma fase mais tardia.
No presente estudo, a menor concentração de
hidroxiprolina encontrada no grupo prednisona nos primeiros dias
pós-operatórios não chegou a prejudicar a integridade
das anastomoses, pois não ocorreram deiscências.
Superada a fase crítica, a prednisona não alterou a concentração
de hidroxiprolina nas anastomoses dos animais
sacrificados mais tardiamente, no décimo quarto dia
pós-operatório. CALI et al. (1993) observaram redução nos níveis
de hidroxiprolina no décimo dia pós-operatório
nas anastomoses co1ônicas de ratos tratados com acetato
de cortisona em relação a ratos do grupo controle,
mas também não se referiram à ocorrência de deiscências
de anastomoses no trabalho publicado. Não houve
diferença estatística significante entre os diversos subgrupos
de animais sacrificados no sexto e décimo quarto dias
após as cirurgias em relação ao estudo bioquímico.
A avaliação histopatológica à microscopia óptica
foi realizada por examinador que desconhecia de que
subgrupo provinha o material examinado. Quantificando-se
os indicadores histopatológicos de acordo com a sua
intensidade e submetendo-os à análise estatística, obtém-se
um importante critério para avaliação da evolução
cicatricial das anastomoses.
HERRMANN et al. (1964) estudaram a
cicatrização de anastomoses colônicas em duzentos e vinte
ratos sacrificados a intervalos desde três horas até um ano
após a cirurgia. Os eventos histológicos do processo
cicatricial apresentaram três fases justapostas, a saber:
1) fase exsudativa (0 a 4 dias): resposta
inflamatória aguda;
2) fase proliferativa (3 a 14 dias): predomínio
da fibroplasia;
3) fase de reorganização e remodelagem (10 a 180
dias ou mais): maturidade do colágeno.
Para que houvesse representatividade das três
fases acima descritas, as datas de sacrificio dos animais,
no presente estudo, recaíram sobre o terceiro, sétimo e
décimo quarto dias após a cirurgia.
Pela histopatologia, tanto o deflazacort, quanto
a prednisona foram eficazes como drogas
antiinflamatórias, pois diminuíram, de modo semelhante, a intensidade
da resposta inflamatória aguda nos primeiros dias do
processo cicatricial das anastomoses colônicas. Ocorreu
também redução na concentração de fibroblastos nas
anastomoses dos animais que receberam corticosteróides
sacrificados no terceiro e sétimo dias pós-operatórios Contudo,
as drogas não provocaram deiscências
anastomóticas. Tardiamente, as drogas não causaram
alterações histológicas no processo cicatricial dos animais
sacrificados no décimo quarto dia.
PHILLIPS et al. (1992) e KIM et al.
(1993), estudando os efeitos da dexametasona nas
anastomoses dos intestinos delgado e grosso de coelhos, também
não observaram deiscências, embora houvesse atraso
no processo cicatricial das anastomoses sob o ponto de
vista histológico. Também MANTOVANI
et al. (1979) encontraram retardo da cicatrização em anastomoses
do intestino grosso de cães sob ação da
hidrocortisona, porém não observaram deiscências, mesmo
usando concomitantemente a azatioprina (droga
imunossupres-sora) no experimento.
A maioria dos trabalhos experimentais, portanto,
tem demonstrado atraso na evolução histológica cicatricial
em anastomoses colônicas sob efeito de
corticosteróides, porém, sem que ocorra número significativamente
maior de deiscências.
CALI et al. (1993), tendo desenvolvido uma das
poucas pesquisas que utilizaram concomitantemente
os parâmetros histógicos, mecânicos e bioquímicos
para estudo da cicatrização de anastomoses colônicas em
ratos sob efeito de cortisona, não encontraram
diferenças histológicas nos diversos subgrupos. Porém,
os pesquisadores relataram diminuição nos níveis
de hidroxiprolina, no décimo dia pós-operatório,
nas anastomoses de ratos que receberam o
corticosteróide em relação ao grupo controle. No mesmo estudo,
os autores não encontraram diferenças na pressão de
ruptura de anastomoses sob efeito de cortisona em relação
ao grupo controle, não tendo havido deiscências.
HENDRIKS & MASTBOOM (1990) destacam que não tem havido correlação entre concentração de
colágeno e parâmetros mecânicos na cicatrização de
anastomoses intestinais em diversas publicações sobre o assunto.
Não tem havido também equivalência entre os
achados histológicos e a concentração de colágeno nas
anastomoses colônicas sob efeito de corticosteróides, tanto no
trabalho de CALI et al. (1993) - em que não ocorreram
alterações histológicas, mas houve diminuição na concentração
de hidroxiprolina -como no presente estudo, em que ocorreram alterações histológicas na cicatrização
das anastomoses dos dois grupos que receberam corticosteróides, mas somente houve diminuição
nos níveis de hidroxiprolina no grupo prednisona.
Os mecanismos de ação dos corticosteróides
na inflamação ainda encontram vasto campo de estudo.
Os glicocorticóides diminuem a migração de leucócitos
para áreas lesadas, além de inibirem a capacidade dessas
células em elaborar diversas substâncias quimiotáxicas (F
AUCI et al., 1976; RAYNES Ir., 1990). Sabe-se, atualmente, que os corticosteróides provocam redução na
liberação do ácido araquidônico através da inibição da atividade
da fosfolipase A2 (FLOWER, 1989). O ácido
araquidônico é o precursor das prostaglandinas, das tromboxanas
e dos leucotrienos, mas para que possa ser utilizado
na formação desses eicosanóides, deve ser
previamente desligado dos fosfolipídios das membranas celulares
pela ação das fosfolipases. A inibição da fosfolipase A2
é induzida indiretamente pelos corticosteróides através
da síntese de uma proteína inibitória identificada
como lipocortina (HIRATA, 1989). Em última análise,
portanto, os corticosteróides inibem a formação de
prostaglandinas, tromboxanas e leucotrienos, importantes
mediadores inflamatórios (LEWIS, 1977; RAYNES Ir., 1990;
VANE & BOTTING, 1995).
Os corticosteróides atuam também na ativação
de receptores glicocorticóides citoplasmáticos, que
regulam a transcrição de alguns genes de resposta
primária, resultando na inibição da expressão de
mediadores inflamatórios, tais como a ciclooxigenase-2 (COX-2) e
a óxido nítrico sintase induzível (iNOS). O
complexo esteróide-receptor também inibe a transcrição
de citoquinas envolvidas em respostas inflamatórias,
como a interleucina 1 e o fator de necrose tumoral (HAYNES Jr., 1990; VANE &
BOTTING, 1995).
A infecção peritoneal contribui para a deiscência
de anastomoses por .favorecer a inflamação e por alterar
o metabolismo do colágeno (SCHROCK et
al., 1973; IRVIN, 1976; BALLANTYNE, 1984; OLIVEIRA, 1995).
A produção da enzima colagenase encontra-se aumentada
na vigência de infecção, levando à degradação e diminuição
do colágeno no intestino, retardando a cicatrização e
propiciando a deiscência da sutura (DUNPHY, 1970; HAWLEY
et al. , 1970a; HAWLEY et al. , 1970b; YAMAKAWA
et al. , 1971; HAWLEY, 1973; HESP et
al., 1984).
Em diferentes trabalhos em que se estudaram os
efeitos dos corticosteróides na cicatrização intestinal,
observaram-se, às vezes, resultados aparentemente paradoxais.
Os corticosteróides poderiam ter um efeito benéfico
à cicatrização, não somente por diminuírem a
inflamação (com menor produção de colagenase), mas também
por atuarem diretamente na inibição da atividade da
enzima colagenase (KOOB et al., 1974). Todavia, a
fase inflamatória é uma etapa essencial da cicatrização,
porque ela desencadeia uma série de eventos celulares
e bioquímicos que ocorrerão numa seqiiência organizada
e complexa, caracterizada pelo aumento da
permeabilidade vascular, quimiotaxia das células da circulação para
dentro do ambiente da ferida, liberação local de citocinas e
fatores do crescimento e ativação de células migrantes (WITTE &
BARBUL, 1997). Os corticosteróides, se
reduzirem excessivamente a resposta inflamatória, poderiam
então passar a prejudicar a cicatrização, por retardarem
as demais fases do processo cicatricial. Mais do que isso,
os corticosteróides têm atuação direta sobre os
fibroblastos, podendo inibir sua proliferação (HARVEY
et al., 1974).
Alterações na qualidade e quantidade do
colágeno presente no intestino, sobretudo na camada
submucosa, influenciam profundamente a integridade da
anastomose. O colágeno não é uma proteína inerte, pois está
em constante equilíbrio entre lise e síntese. A diminuição
na quantidade de colágeno pode ocorrer tanto por
aumento na lise, quanto por diminuição da síntese
protéica (HAWLEY, 1973; PEREZ-TAMAYO, 1978).
É nesse fino balanço que os corticosteróides
podem interferir, prejudicando ou favorecendo o
processo cicatricial, fazendo suscitar um número crescente
de pesquisas, na tentativa de elucidação do
papel, aparentemente contraditório, que exercem na
cicatrização de anastomoses do intestino grosso.
Por motivos que ainda não são compreendidos,
os corticosteróides parecem afetar menos a cicatrização
do cólon do que outros tecidos, porque não .ocorre
aumento na taxa de deiscência das suturas do intestino grosso
nos animais sob efeito dessas drogas. A mais temível
das complicações cirúrgicas do intestino grosso, a
deiscência de uma anastomose, não ocorreu na presente pesquisa
e é quase inexistente nos trabalhos experimentais
publicados em que se estudou a influência de corticosteróides
no processo cicatricial colônico (HOUSTON &
ROTSTEIN, 1988; MASTBOOM et al., 1991b; PHILLIPS
et al., 1992; CALI et al., 1993; KIM
et al., 1993; FURST et al., 1994; DEL RIO
et al., 1996; EUBANKS et al., 1997; SIRIMARCO
et al., 1999). Há correlação clínica
com esses achados de laboratório, uma vez que, em
pelo menos três grandes séries retrospectivas (PRICE,
1968; SCHROCK et al., 1973; JEX et al.,
1987), os autores não encontraram diferenças significativas nos índices
de deiscências em anastomoses intestinais de
pacientes operados na vigência de corticosteróides.
As propriedades antiinflamatórias dos
glicocorticóides são múltiplas e não específicas. Há grande variedade
de preparações de corticosteróides disponíveis para uso
no tratamento de doenças inflamatórias intestinais
que diferem em potência e biodisponibilidade (HANAEUR
& BAERT, 1994). Há poucos estudos comparativos
entre diferentes formulações de corticosteróides. Quando
se verifica a influência dessas drogas na cicatrização
de anastomoses colônicas, somente o trabalho de
EUBANKS et al. (1997) mostra a comparação dos efeitos de
três diferentes corticosteróides, utilizando o rato como
animal de experimentação. Apesar dos autores
terem argumentado que usaram doses
antiinflamatórias equipotentes, as drogas estudadas eram diferentes no
que diz respeito à biodisponibilidade, pois a
hidrocortisona tem meia-vida biológica curta (8 a 12 horas),
a metilprednisolona tem meia-vida biológica
intermediária (12 a 36 horas) e a dexametasona tem meia-vida
biológica longa (36 a 72 horas). Além disso, as drogas
foram administradas por via intramuscular, o que faz com
que as potências dos glicocorticóides possam diferir
muito, quando administrados por essa via, dificultando a
relação de equivalência entre as drogas (SCHIMMER
& PARKER, 1996). Mesmo assim, EUBANKS et al.
(1997) não relataram diferenças nas pressões de ruptura
das anastomoses colônicas entre os ratos do grupo controle
e os animais que receberam hidrocortisona,
metilpred-nisolona ou dexametasona em doses consideradas
eleva-das pelos próprios autores.
Embora a utilização clínica da prednisona seja
vasta, a influência desse corticosteróide na cicatrização
de anastomoses colônicas em animais não havia ainda
sido relatada. Na presente investigação, foram utilizados
dois corticosteróides sintéticos de meia-vida biológica
inter-mediária, o deflazacort e a prednisona, em doses
antiin-flamatórias equipotentes, para se comparar os
efeitos dessas drogas na cicatrização de anastomoses
colônicas de ratos. Apesar da prednisona e do deflazacort não
terem provocado deiscências anastomóticas nos
cólons operados, observou-se, pela histopatologia, que as
duas drogas, de modo semelhante, diminuíram a
reação inflamatória aguda do processo cicatricial e reduziram
a concentração de fibroblastos no terceiro e sétimo
dias pós-operatórios. Não houve diferenças
estatisticamente significantes nos indicadores histopatológicos
da cicatrização no décimo quarto dia pós- operatório.
A utilização do deflazacort foi vantajosa em relação
à prednisona no estudo bioquímico, pois o deflazacort
não provocou a diminuição da concentração tecidual
de hidroxiprolina nas anastomoses colônicas realizadas
em ratos sacrificados no terceiro e sétimo dias
pós-operatórios. No décimo .quarto dia, não houve
diferenças estatísticas significantes nas concentrações
de hidroxiprolina das anastomoses colônicas entre
os subgrupos estudados.
5 - CONCLUSÃO
Nas condições em que esta investigação
experimental foi realizada, o deflazacort provocou menos
efeitos deletérios à cicatrização do que a prednisona, pois no
estudo bioquímico não houve diminuição da concentração
tecidual de hidroxiprolina nas anastomoses colônicas de
ratos tratados com o deflazacort, sacrificados no terceiro e
sétimo dias pós-operatórios.
Quanto aos achados histopatológicos,
ambos corticosteróides reduziram, de maneira semelhante,
a intensidade da reação inflamatória aguda do
processo cicatricial e a concentração de fibroblastos no terceiro
e sétimo dias pós-operatórios.
6 - ANEXOS
Tabela 1.
Distribuição ponderal dos animais nos subgrupos C3, D3 e P3
| Subgrupo Controle (C3)
|
Subgrupo Deflazacort (D3)
|
Subgrupo Prednisona (P3)
|
| PESO (g) |
PESO (g) |
PESO (g) |
|
Início |
Cirurgia |
Sacrificio |
|
Início |
Cirurgia |
Sacrificio |
|
Início |
Cirurgia |
Sacrificio |
| C3- 1 |
305 |
318 |
309 |
D3- 1 |
300 |
282 |
260 |
P3-
1 |
310 |
295 |
270 |
| C3- 2 |
320 |
335 |
314 |
D3- 2 |
305 |
289 |
266 |
P3-
2 |
320 |
310 |
290 |
| C3- 3 |
335 |
345 |
320 |
D3- 3 |
320 |
305 |
292 |
P3-
3 |
340 |
315 |
305 |
| C3- 4 |
300 |
312 |
295 |
D3- 4 |
302 |
290 |
275 |
P3-
4 |
312 |
308 |
300 |
| C3- 5 |
310 |
320 |
305 |
D3- 5 |
340 |
330 |
315 |
P3-
5 |
300 |
285 |
265 |
| C3- 6 |
308 |
340 |
323 |
D3- 6 |
307 |
295 |
270 |
P3-
6 |
335 |
312 |
285 |
| C3- 7 |
332 |
350 |
330 |
D3- 7 |
308 |
298 |
281 |
P3-
7 |
334 |
335 |
315 |
| C3- 8 |
302 |
323 |
300 |
D3- 8 |
330 |
291 |
265 |
P3-
8 |
335 |
330 |
310 |
| C3- 9 |
307 |
320 |
320 |
D3- 9 |
340 |
324 |
300 |
P3-
9 |
308 |
302 |
290 |
| C3-10 |
315 |
325 |
298 |
D3-10 |
315 |
300 |
280 |
P3-10 |
305 |
290 |
275 |
| Média |
313,4 |
328,8 |
311,4 |
|
316,7 |
300,4 |
280,4 |
|
319,9 |
308,2 |
290,5 |
| Desvio
padrão |
12,1 |
12,8 |
11,8 |
|
15,1 |
15,4 |
17,3 |
|
14,8 |
16,1 |
17,0 |
Tabela 2.
Distribuição ponderal dos animais nos subgrupos C7, D7 e P7
| Subgrupo Controle
(C7)
|
Subgrupo Deflazacort
(D7)
|
Subgrupo Prednisona
(P7)
|
| PESO (g) |
PESO (g) |
PESO (g) |
|
Início |
Cirurgia |
Sacrificio |
|
Início |
Cirurgia |
Sacrificio |
|
Início |
Cirurgia |
Sacrificio |
| C7- 1 |
310 |
320 |
320 |
D7- 1 |
305 |
290 |
260 |
P7- 1 |
302 |
290 |
270 |
| C7- 2 |
300 |
310 |
315 |
D7- 2 |
300 |
290 |
270 |
P7-
2 |
305 |
285 |
265 |
| C7- 3 |
315 |
315 |
300 |
D7- 3 |
335 |
320 |
265 |
P7-
3 |
330 |
310 |
305 |
| C7- 4 |
330 |
350 |
335 |
D7- 4 |
302 |
285 |
275 |
P7-
4 |
302 |
300 |
287 |
| C7- 5 |
325 |
344 |
332 |
D7- 5 |
330 |
295 |
239 |
P7-
5 |
308 |
310 |
305 |
| C7- 6 |
300 |
308 |
304 |
D7- 6 |
315 |
308 |
262 |
P7-
6 |
300 |
295 |
280 |
| C7- 7 |
302 |
332 |
323 |
D7- 7 |
335 |
327 |
320 |
P7-
7 |
315 |
312 |
304 |
| C7- 8 |
320 |
328 |
310 |
D7- 8 |
330 |
310 |
290 |
P7-
8 |
310 |
295 |
261 |
| C7- 9 |
324 |
335 |
360 |
D7- 9 |
322 |
300 |
265 |
P7-
9 |
325 |
323 |
297 |
| C7-10 |
305 |
315 |
330 |
D7-10 |
330 |
295 |
260 |
P7-10 |
320 |
315 |
265 |
| Média |
313,1 |
325,7 |
322,9 |
|
317,4 |
302,0 |
270,6 |
|
311,7 |
303,5 |
283,9 |
| Desvio padrão |
11,2 |
14,4 |
17,5 |
|
14,7 |
13,8 |
21,5 |
|
10,4 |
12,2 |
18,0 |
Tabela 3.
Distribuição pondera1 dos animais nos subgrupos C14, D14 e P14
| Subgrupo Controle
(C14)
|
Subgrupo Deflazacort
(D14)
|
Subgrupo Prednisona
(P14)
|
| PESO (g) |
PESO (g) |
PESO (g) |
|
Início |
Cirurgia |
Sacrificio |
|
Início |
Cirurgia |
Sacrificio |
|
Início |
Cirurgia |
Sacrificio |
| C14- 1 |
305 |
315 |
330 |
D14- 1 |
315 |
302 |
290 |
P14- 1 |
335 |
330 |
325 |
| C14- 2 |
320 |
325 |
335 |
D14- 2 |
320 |
290 |
275 |
P14-
2 |
340 |
335 |
328 |
| C14- 3 |
300 |
310 |
315 |
D14- 3 |
330 |
298 |
260 |
P14-
3 |
310 |
318 |
310 |
| C14- 4 |
322 |
335 |
365 |
D14- 4 |
325 |
308 |
325 |
P14-
4 |
320 |
315 |
308 |
| C14- 5 |
329 |
349 |
340 |
D14- 5 |
310 |
290 |
260 |
P14-
5 |
330 |
320 |
324 |
| C14- 6 |
317 |
330 |
353 |
D14- 6 |
305 |
280 |
270 |
P14- 6 |
305 |
300 |
300 |
| C14- 7 |
310 |
334 |
356 |
D14- 7 |
308 |
300 |
295 |
P14-
7 |
310 |
308 |
305 |
| C14- 8 |
330 |
350 |
372 |
D14- 8 |
335 |
310 |
300 |
P14-
8 |
305 |
302 |
300 |
| C14- 9 |
315 |
320 |
óbito |
D14- 9 |
320 |
295 |
280 |
P14-
9 |
300 |
295 |
300 |
| C14-10 |
340 |
360 |
375 |
D14-10 |
325 |
305 |
291 |
P14-10 |
315 |
310 |
306 |
| Média |
318,8 |
332,8 |
349,0 |
|
319,3 |
297,8 |
284,6 |
|
317,0 |
313,3 |
310,6 |
| Desvio padrão |
12,1 |
16,2 |
20,3 |
|
9,7 |
9,2 |
19,9 |
|
13,7 |
12,9 |
10,9 |
Tabela 4.
Indicadores histopatológicos do processo cicatricial nas anastomoses dos animais do subgrupo controle
sacrificados no terceiro dia após a cirurgia
| |
Animais do Subgrupo C3
|
| |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Crosta fibrino leucocitária |
+++ |
+ |
++ |
+ |
+++ |
+++ |
+++ |
++ |
+++ |
++ |
| Necrose focal |
+++ |
+ |
++ |
+ |
+++ |
+++ |
+++ |
++ |
+++ |
++ |
| Exsudato neutrofílico |
+++ |
+ |
++ |
+ |
+++ |
+++ |
+++ |
++ |
+++ |
++ |
| Edema |
+++ |
+ |
++ |
+ |
++ |
+++ |
++ |
+++ |
++ |
++ |
| Dilatação linfática |
++ |
+ |
+ |
+ |
+ |
+++ |
+ |
+++ |
++ |
++ |
| Congestão vascular |
+++ |
+ |
++ |
+ |
++ |
+++ |
++ |
++ |
++ |
++ |
| Hemorragia focal |
++ |
|
++ |
+ |
+ |
++ |
++ |
++ |
+ |
+ |
| Exsudato eosinofílico |
+++ |
++ |
+++ |
++ |
++ |
+++ |
++ |
+++ |
++ |
++ |
| Regeneração mucosa |
+ |
|
|
|
|
|
|
|
|
|
| Infiltrado mononuclear |
+ |
+ |
+ |
+ |
++ |
+ |
+ |
+ |
+ |
+ |
| Infiltração macrofágica |
+ |
+ |
+ |
+ |
++ |
+ |
+ |
+ |
+ |
+ |
| Granulomas |
|
|
|
|
|
|
|
|
|
|
| Neoformação vascular |
+ |
|
|
|
+ |
|
|
|
|
|
| Proliferação fibroblástica |
++ |
++ |
+ |
+ |
++ |
++ |
++ |
+ |
++ |
+ |
| Fibrose |
+ |
+ |
|
+ |
+ |
+ |
+ |
|
+ |
|
|
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
|
Tabela 5.
Indicadores histopatológicos do processo cicatricial nas anastomoses dos animais do subgrupo controle
sacrificados no sétimo dia após a cirurgia
| |
Animais do Subgrupo C7
|
| |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Crosta fibrino leucocitária |
+ |
++ |
|
|
+ |
|
|
|
+ |
|
| Necrose focal |
+ |
++ |
|
|
+ |
|
|
|
++ |
|
| Depósitos de fibrina |
+ |
++ |
|
|
+ |
|
|
|
++ |
|
| Exsudato neutrofílico |
+ |
+ |
|
+ |
+ |
+ |
+ |
+ |
+ |
+ |
| Edema |
+ |
++ |
+ |
+ |
++ |
+ |
+ |
+ |
+ |
+ |
| Dilatação linfática |
+ |
|
|
|
|
|
|
|
+ |
+ |
| Congestão vascular |
+ |
++ |
+ |
+ |
+ |
+ |
|
+ |
++ |
++ |
| Hemorragia focal |
+ |
|
|
|
|
|
|
|
|
|
| Exsudato eosinofílico |
++ |
++ |
+ |
+ |
++ |
+ |
+ |
++ |
++ |
+ |
| Regeneração mucosa |
++ |
+ |
++ |
++ |
++ |
+++ |
+ |
++ |
+ |
+ |
| Infiltrado mononuclear |
++ |
++ |
++ |
++ |
++ |
+++ |
++ |
++ |
+ |
+ |
| Infiltração macrofágica |
++ |
++ |
+ |
++ |
++ |
+++ |
++ |
++ |
+ |
+ |
| Granulomas |
|
+ |
|
+ |
+ |
+++ |
+ |
|
+ |
|
| Neoformação vascular |
+++ |
++ |
++ |
++ |
++ |
++ |
++ |
++ |
++ |
++ |
| Proliferação fibroblástica |
+++ |
++ |
+++ |
++ |
++ |
+++ |
++ |
+++ |
++ |
+++ |
| Fibrose |
+++ |
++ |
++ |
++ |
++ |
++ |
++ |
++ |
++ |
++ |
|
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
|
Tabela 6.
Indicadores histopatológicos do processo cicatricial nas anastomoses dos animais do subgrupo controle
sacrificados no décimo quarto dia após a cirurgia
| |
Animais do Subgrupo C14
|
| |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Crosta fibrino leucocitária |
|
|
|
|
|
|
|
|
ó |
|
| Necrose focal |
|
|
|
|
|
|
|
|
b |
|
| Depósitos de fibrina |
|
|
|
|
|
|
|
|
i |
|
| Exsudato neutrofílico |
|
|
|
|
|
|
|
|
t |
|
| Edema |
|
|
+ |
|
|
|
|
|
o |
|
| Dilatação linfática |
+ |
|
|
|
|
|
|
|
|
|
| Congestão vascular |
|
|
+ |
+ |
|
|
|
+ |
|
+ |
| Hemorragia focal |
|
|
|
+ |
|
|
|
|
|
|
| Exsudato eosinofílico |
+ |
|
+ |
+ |
|
|
|
+ |
|
+ |
| Regeneração mucosa |
+++ |
+++ |
+++ |
++ |
++ |
++ |
+++ |
++ |
|
+++ |
| Infiltrado mononuclear |
++ |
++ |
++ |
+ |
+ |
+ |
+ |
+ |
|
+ |
| Infiltração macrofágica |
++ |
++ |
++ |
+ |
+ |
+ |
+ |
+ |
|
+ |
| Granulomas |
|
|
|
+ |
|
+++ |
|
|
|
|
| Neoformação vascular |
++ |
+++ |
++ |
+ |
+++ |
+++ |
++ |
++ |
|
++ |
| Proliferação fibroblástica |
++ |
+++ |
++ |
++ |
++ |
+ |
+ |
+ |
|
+ |
| Fibrose |
++ |
+++ |
+++ |
++ |
+++ |
++ |
+++ |
++ |
|
++ |
|
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
|
Tabela 7.
Indicadores histopatológicos do processo cicatricial nas anastomoses dos animais do subgrupo deflazacort
sacrificados no terceiro dia após a cirurgia.
| |
Animais do Subgrupo D3
|
| |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Crosta fibrino leucocitária |
++ |
++ |
|
++ |
+ |
+++ |
+++ |
+++ |
+ |
++ |
| Necrose focal |
++ |
++ |
|
++ |
+ |
+++ |
+++ |
+++ |
+ |
++ |
| Depósitos de fibrina |
++ |
++ |
|
++ |
+ |
+++ |
+++ |
+++ |
+ |
++ |
| Exsudato neutrofílico |
+ |
+ |
+ |
++ |
+ |
++ |
+ |
++ |
+ |
+ |
| Edema |
+ |
+ |
+ |
++ |
+ |
+ |
++ |
++ |
+ |
+ |
| Dilatação linfática |
|
+ |
+ |
++ |
+ |
+ |
++ |
+ |
|
+ |
| Congestão vascular |
+ |
+ |
++ |
++ |
+ |
+ |
+ |
+++ |
|
+ |
| Hemorragia focal |
+ |
++ |
+ |
++ |
+ |
++ |
+ |
++ |
+ |
|
| Exsudato eosinofílico |
+ |
+ |
+ |
++ |
+ |
++ |
+ |
++ |
+ |
|
| Regeneração mucosa |
|
|
|
|
|
|
|
|
|
|
| Infiltrado mononuclear |
+ |
+ |
+ |
+ |
|
|
+ |
|
|
|
| Infiltração macrofágica |
+ |
+ |
+ |
+ |
|
|
+ |
|
|
|
| Granulomas |
|
|
|
|
|
|
|
|
|
|
| Neoformação vascular |
|
+ |
|
|
|
+ |
|
+ |
|
|
| Proliferação fibroblástica |
+ |
+ |
|
+ |
|
|
+ |
|
|
|
| Fibrose |
+ |
+ |
|
+ |
|
|
+ |
|
|
|
|
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
|
Tabela 8.
Indicadores histopatológicos do processo cicatricial nas anastomoses dos animais do subgrupo def1azacort
sacrificados no sétimo dia após a cirurgia.
| |
Animais do Subgrupo D7
|
| |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Crosta fibrino leucocitária |
++ |
+ |
|
|
e |
|
++ |
+++ |
+ |
+ |
| Necrose focal |
++ |
+ |
|
|
l |
|
++ |
+++ |
+ |
+ |
| Depósitos de fibrina |
++ |
+ |
|
++ |
i |
|
++ |
+++ |
+ |
+ |
| Exsudato neutrofílico |
+ |
+ |
+ |
|
m |
|
|
+ |
|
+ |
| Edema |
+ |
+ |
|
|
i |
+ |
+ |
++ |
+ |
++ |
| Dilatação linfática |
+ |
+ |
|
|
n |
|
|
+ |
+ |
+ |
| Congestão vascular |
+ |
+ |
+ |
+ |
a |
++ |
+ |
+ |
+ |
+ |
| Hemorragia focal |
|
|
+ |
|
d |
|
|
|
|
|
| Exsudato eosinofílico |
+ |
+ |
+ |
+ |
o |
+ |
+ |
+ |
+ |
++ |
| Regeneração mucosa |
++ |
+ |
++ |
+++ |
|
++ |
+ |
+ |
+ |
+ |
| Infiltrado mononuclear |
+ |
+ |
++ |
++ |
|
++ |
+ |
+ |
+ |
+ |
| Infiltração macrofágica |
+ |
+ |
++ |
++ |
|
++ |
+ |
+ |
+ |
+ |
| Granulomas |
|
+ |
+ |
|
|
|
|
|
|
|
| Neoformação vascular |
++ |
++ |
++ |
++ |
|
++ |
++ |
+ |
++ |
++ |
| Proliferação fibroblástica |
++ |
++ |
++ |
++ |
|
++ |
++ |
+ |
++ |
++ |
| Fibrose |
+ |
++ |
++ |
++ |
|
++ |
++ |
+ |
++ |
++ |
|
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
|
Tabela 9.
Indicadores histopatológicos do processo cicatricial nas anastomoses dos
animais do subgrupo deflazacort sacrificados no décimo quarto dia após a cirurgia.
| |
Animais do Subgrupo D14
|
| |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Crosta fibrino leucocitária |
+ |
|
+ |
|
|
|
|
|
|
|
| Necrose focal |
+ |
+ |
+ |
|
|
|
|
|
|
|
| Depósitos de fibrina |
+ |
|
+ |
++ |
|
|
|
|
|
|
| Exsudato neutrofílico |
|
|
+ |
|
|
|
|
|
|
|
| Edema |
+ |
|
++ |
|
|
|
+ |
|
|
|
| Dilatação linfática |
+ |
|
+ |
|
|
|
|
|
|
|
| Congestão vascular |
+ |
|
+ |
|
|
|
+ |
+ |
+ |
+ |
| Hemorragia focal |
|
|
|
|
|
|
|
|
|
|
| Exsudato eosinofílico |
|
|
+ |
+ |
|
|
++ |
+ |
+ |
+ |
| Regeneração mucosa |
++ |
+++ |
++ |
++ |
+++ |
+++ |
++ |
++ |
++ |
+++ |
| Infiltrado mononuclear |
+ |
++ |
+ |
+ |
+ |
+ |
++ |
++ |
++ |
+ |
| Infiltração macrofágica |
+ |
++ |
+ |
+ |
+ |
+ |
++ |
++ |
++ |
+ |
| Granulomas |
|
+ |
++ |
+ |
|
|
|
|
+ |
|
| Neoformação vascular |
++ |
++ |
+ |
+++ |
+ |
+++ |
++ |
++ |
++ |
++ |
| Proliferação fibroblástica |
++ |
++ |
+ |
++ |
++ |
+ |
+ |
+ |
++ |
+ |
| Fibrose |
++ |
+++ |
++ |
++ |
+++ |
++ |
++ |
+++ |
+++ |
++ |
|
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
|
Tabela 10.
Indicadores histopatológicos do processo cicatricial nas anastomoses dos
animais do subgrupo prednisona sacrificados no terceiro dia após a cirurgia
| |
Animais do Subgrupo C3
|
| |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Crosta fibrino leucocitária |
+ |
+ |
++ |
+++ |
+++ |
+ |
+ |
+++ |
+++ |
++ |
| Necrose focal |
+ |
+ |
++ |
+++ |
+++ |
+ |
+ |
+++ |
+++ |
++ |
| Depósitos de fibrina |
+ |
+ |
++ |
+++ |
+++ |
+ |
+ |
+++ |
+++ |
++ |
| Exsudato neutrofílico |
+ |
+ |
+ |
++ |
+ |
|
+ |
++ |
++ |
+ |
| Edema |
+ |
+ |
+ |
+++ |
+ |
+ |
+ |
++ |
++ |
++ |
| Dilatação linfática |
+ |
+ |
++ |
++ |
+ |
+ |
+ |
+++ |
++ |
+ |
| Congestão vascular |
+ |
+ |
+ |
+++ |
+ |
+ |
++ |
++ |
+ |
+ |
| Hemorragia focal |
+ |
|
+ |
++ |
+ |
+ |
+ |
++ |
++ |
|
| Exsudato eosinofílico |
+ |
+ |
++ |
++ |
+ |
+ |
+ |
++ |
+ |
+ |
| Regeneração mucosa |
|
+ |
|
|
|
|
|
|
|
|
| Infiltrado mononuclear |
+ |
|
+ |
+ |
|
|
|
|
|
+ |
| Infiltração macrofágica |
+ |
|
+ |
+ |
|
|
|
|
|
+ |
| Granulomas |
|
|
|
|
|
|
|
|
|
|
| Neoformação vascular |
|
|
|
+ |
|
+ |
|
+ |
+ |
|
| Proliferação fibroblástica |
+ |
+ |
+ |
+ |
|
|
|
|
|
+ |
| Fibrose |
+ |
+ |
+ |
+ |
|
|
|
|
+ |
|
|
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
|
Tabela 11.
Indicadores histopatológicos do processo cicatricial nas anastomoses dos animais do subgrupo prednisona
sacrificados no sétimo dia após a cirurgia
| |
Animais do Subgrupo C3
|
| |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Crosta fibrino leucocitária |
+ |
|
|
+ |
|
|
|
+ |
|
++ |
| Necrose focal |
+ |
|
|
+ |
|
|
|
+ |
|
++ |
| Depósitos de fibrina |
+ |
|
|
+ |
|
|
|
+ |
|
++ |
| Exsudato neutrofílico |
+ |
|
|
+ |
|
|
|
|
|
+ |
| Edema |
+ |
+ |
+ |
+ |
+ |
|
|
|
+ |
++ |
| Dilatação linfática |
|
|
|
+ |
+ |
|
+ |
+ |
+ |
+ |
| Congestão vascular |
+ |
+ |
+ |
+ |
|
+ |
+ |
+ |
+ |
+ |
| Hemorragia focal |
|
|
+ |
|
|
|
|
|
|
|
| Exsudato eosinofílico |
+ |
+ |
+ |
+ |
+ |
|
+ |
+ |
+ |
++ |
| Regeneração mucosa |
|
|
|
|
|
|
|
|
|
|
| Infiltrado mononuclear |
++ |
+ |
+ |
+ |
++ |
++ |
+ |
+ |
+ |
+ |
| Infiltração macrofágica |
++ |
+ |
+ |
+ |
++ |
++ |
+ |
+ |
+ |
+ |
| Granulomas |
+ |
|
|
+ |
+ |
|
|
|
++ |
|
| Neoformação vascular |
++ |
++ |
++ |
++ |
++ |
++ |
++ |
++ |
++ |
++ |
| Proliferação fibroblástica |
+++ |
++ |
++ |
++ |
++ |
++ |
++ |
+ |
++ |
++ |
| Fibrose |
+++ |
++ |
++ |
++ |
++ |
++ |
++ |
+ |
++ |
+ |
|
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
|
Tabela 12.
Indicadores histopatológicos do processo cicatricial nas anastomoses dos
animais do subgrupo prednisona sacrificados no décimo quarto dia após a cirurgia
| |
Animais do Subgrupo D14
|
| |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| Crosta fibrino leucocitária |
|
|
|
|
|
|
|
|
|
|
| Necrose focal |
|
|
|
|
|
|
|
|
|
|
| Depósitos de fibrina |
|
|
|
|
|
|
|
|
|
|
| Exsudato neutrofílico |
|
|
|
|
|
|
|
|
|
|
| Edema |
|
++ |
+ |
|
|
|
|
|
|
|
| Dilatação linfática |
|
|
+ |
|
|
|
+ |
|
|
|
| Congestão vascular |
|
+ |
|
+ |
+ |
|
+ |
|
|
|
| Hemorragia focal |
|
|
|
|
|
|
|
|
|
|
| Exsudato eosinofílico |
|
|
+ |
+ |
++ |
|
|
+ |
+ |
|
| Regeneração mucosa |
+++ |
+++ |
++ |
+++ |
++ |
+++ |
++ |
++ |
+++ |
+++ |
| Infiltrado mononuclear |
+ |
+ |
+ |
+ |
+ |
+ |
++ |
++ |
+ |
+ |
| Infiltração macrofágica |
+ |
+ |
+ |
+ |
+ |
+ |
++ |
++ |
+ |
+ |
| Granulomas |
|
|
|
|
|
++ |
|
+ |
|
|
| Neoformação vascular |
+ |
+ |
+++ |
++ |
+++ |
+ |
++ |
++ |
+ |
++ |
| Proliferação fibroblástica |
+ |
+ |
+++ |
++ |
++ |
+ |
++ |
+ |
+ |
+ |
| Fibrose |
+++ |
+++ |
++ |
+++ |
++ |
+++ |
++ |
++ |
++ |
+++ |
|
( ) = ausente; ( + ) = leve; ( + + ) = moderado; ( + + + ) = intenso
|
SUMMARY: Ninety rats were studied in order to compare the effects of two synthetic corticosteroids, prednisone and deflazacort,
on the healing of large bowel anastomosis. Thirty rats received 1.25mg/kg/day prednisone, thirty rats received 1.5mg/kg/day
deflazacort and thirty control rats received a 0.9% sodium chloride solution. The drugs were administered by gavage from the seventh day
before surgery to the day of sacrifice. The animals were submitted to segmental resection of the distal colon and to reconstitution of
intestinal transit by end-to-end anastomosis on a sing1e layer, with continuous invaginating polypropylene 6-0 sutures. The animals were
sacrificed at three, seven and fourteen days according to random selection of the subgroup to which they belonged. Animal body
weight, clinical course, abdominal cavity, macro-and microscopic aspects of the anastomosis, and tissue hydroxyproline concentrations
were recorded. Deflazacort provoked fewer deleterius effects than prednisone in terms of healing since the biochemical study showed
no reduction of tissue hydroxyproline concentrations in the colonic anastomoses of rats treated with deflazacort and sacrificed on the
third and seventh postoperative days. By the histopathological findings, both corticosteroids simi1arly reduced the intensity of the
acute inflammatory reaction of the healing process, as well as fibroblasts concentration on the third and seventh postoperative days.
7 - REFERENCIAS BIBLIOGRAFICAS
1. APRILLI, F.; GUIMARÃES, A.S.; ROCHA, J.J.R.da.
Anastomoses intestinais. In: SILVA JUNIOR, O.C.; ZUCOLOTO, S.; BEER JUNIOR,
A. (ed.). Modelos experimentais de pesguisa em cirurgia.
São Paulo, Robe Editorial, 1998. cap. 38, p. 421-32.
2. ARIZON, J.M.; ANGUITA, M.; VALLES, F.; MONTERO, A.;
SANCHO, M.; LOPEZ-RUBIO, F.; LATRE, J.M.; CALLEJA, F.; CASARES,
J.; ROMÁN, M.; SEGURA, C.; CONCHA, M. Preliminary experience
with deflazacort, a new synthetic steroid with fewer undesirable side
effects, in heart transplant patients. J. Heart Lung Trans~lant.,
v.12, p. 445-9,1993.
3. ASZODI, A.; PONSKY, J .L. Effects of corticosteroid on the healing
bowel anastomosis. Am. Surg., v. 50, p. 546-8, 1984.
4. BAILEY, H.R.; LA VOO, J.W.; MAX, E.; SMITH, K.W.; HAMPTON,
J.M. Single-layer continuous colorectal anastomosis.
Aust. N.Z.J. Surg., v. 51, p. 473-6, 1981.
5. BAILEY, H.R.; LA VOO, J.W.; MAX, E.; SMITH, K.W.; BUTTS,
D.R.; HAMPTON, J .M. Single-layer polypropylene colorectal
anastomosis. Experience with 100 cases. Dis. Colon Rectum,
v. 27, p. 19-23,1984.
6. BALLANTYNE, G.H. Intestinal suturing. Review of the
experimental foundations for traditional doctrines.
Dis. Colon Rectum, v. 26, p. 836-43, 1983.
7. BALLANTYNE, G.H. The experimental basis of intestinal suturing.
Effect of surgical technique, inflammation, and infection on enteric
wound healing. Dis. Colon Rectum, v. 27, p. 61-71,1984.
8. BALSAN, S.; STERU, D.; BOURDEAU, A.; GRIMBERG, R.; LENOIR,
G. Effects of long-term maintenance therapy with a new
glucocorticoid, deflazacort, on mineral metabolism and statural growth.
Calcif. Tissue Int., v. 40, p. 303-9, 1987.
9. BEAHRS, O.H. Complications of colonic surgery.
Surg. Clin. North Am., v. 47, p. 983-8,1967.
10. BLAKE, D.P.; BUBRICK, M.P.; KOCHSIEK, G.G.; FEENEY,
D.A.; JOHNSTON, G.R.; STROM, R.L.; HITCHCOCK, C.R. Low
anterior anastomotic dehiscence following preoperative irradiation with 6.000
rads. Dis. Colon Rectum, v. 27, p. 176-81, 1984.
11. BOTOMAN, V.A.; BONNER, G.F.; BOTOMAN, D.A. Management
of .inflammatory bowel disease. Am. Fam. Physician,
v. 57, p. 57-68, 71-2, 1998.
12. BRENNAN, S.S.; FOSTER, M.E.; MORGAN, A.; LEAPER,
D.J. Prostaglandins in colonic anastomotic healing.
Dis. Colon Rectum, v. 27, p. 723-5, 1984.
13. BROYER, M.; TERZI, F.; LEHNERT, A.; GAGNADOUX, M.F.; GUEST,
G.; NIAUDET, P. A controlled study of deflazacort in the treatment of
idiopathic nephrotic syndrome. Pediatr. Ne~hro1.,
v. 11, p. 418-22,1997.
14. BRUNO, A.; CAVALLO-PERIN, P .; CASSADER, M.; PAGANO,
G. .Deflazacort vs prednisone. Effect on b1ood glucose contro1 in
insu1in-treated diabetics. Arch. Intem. Med.,
v. 147, p. 679-80, 1987.
15. BUNIV A, G.; DUBINI, A.; SASSELLA, D. Human bioassay of
coticotropin- suppressing, eosinopenic and hyperg1ycaemic potencies of
deflazacort and prednisone. Curr. Ther. Res.,
v. 26, p. 69-81, 1979.
16. CALACHE NETO, J.E.; AUN, F.; YOUNES, R.N. Efeitos da
administração do diclofenaco sódico a ratos submetidos a suturas cólicas.
Rev. Bras. Co1o-Proct., v. 12, p. 37-46, 1992.
17. CALI, R.L.; SMYRK, T.C.; BLATCHFORD, G.J.; THORSON, A.G.; CHRISTENSEN, M.A. Effect of prostag1andin E1 and steroid on
hea1ing co1onic anastomosis. Dis. Co1on Rectum,
v.36, p. 1148-51, 1993.
18. CAVALLO-PERIN, P.; BRUNO, A.; OZZELLO, A.; DALL'OMO,
A.M.; LOMBARDI, A.; CASSADER, M.; IMBIMBO, B.; PAGANO,
G. Comparison of acute and subacute effects of deflazacort and
prednisone on glucose metabo1ism in man. Eur. J. Clin. Pharmacol.,
v. 26, p. 357-62, 1984.
19. CLARK, R.A.F. Wound repair. Overview and general considerations.
In: CLARK, R.A.F. (ed.). The molecular and cellular biology of wound
repair. 2.ed. New York, Plenum Press, 1996. cap. 1, p. 3-50.
20. COHEN, S.R.; CORNELL, C.N.; COLLINS, M.H.; SELL, J.E.; BLANC,
W.A.; ALTMAN, R.P. Healing of ischemic colonic anastomosis in the rat: role
of antibiotic preparation. Surgery, v. 97, p. 443-6,1985.
21. COLIN , J.F.; ELLIOT, P.; ELLIS, H. The effect of uraemia upon
wound healing: an experimental study. Br. J. Surg.,
v. 66, p. 793- 7, 1979.
22. CRISCUOLO, D.; FRAIOLI, F.; BONIF ACIO, V.; P AOLUCCI, D.;
ISIDORI, A. Effects of a new glucocorticoid, deflazacort, on
pituitary-adrenal function in man: a comparison with prednisone.
Int. J. Clin. Pharmacol. Ther. Toxicol., v. 18, p. 37-41, 1980.
23. CRONIN, K.; JACKSON, D.S.; DUNPHY, J.E. Changing bursting
strength and collagen content of the healing colon.
Surg. Gynecol. Obstet., v.126, p.747- 53, 1968a.
24. CRONIN, K.; JACKSON, D.S.; DUNPHY, J.E. Specific activity
of hydroxypro1ine-tritium in healing colon. Surg. Gy!!ecol. Obstet.,
v. 126, p.1061-5,1968b.
25. DALY, J.M.; VARS, H.M.; DUDRICK, S.J. Effects of protein depletion
on strength of colonic anastomosis. Surg. Gynecol. Obstet.,
v. 134, p. 15-21, 1972.
26. DEBAS, H. T .; THOMSON, F .B. A critical review of colectomy
with .anastomosis. Surg. Gynecol. Obstet., v. 135, p. 747-52, 1972.
27. DEL RIO, J.V.; BECK, D.E.; OPELKA, F.G. Chronic perioperative
steroids and colonic anastomotic healing in rats.
J. Surg. Res., v. 66, p. 138-42, 1996.
28. DUNPHY, J.E. The cut gut. Am. J. Surg.,
v. 119, p. 1-8, 1970.
29. ECKES, B.; AUMAILLEY, M.; KRIEG, T. Collagens and the
reestablishment of dermal integrity. In: CLARK, R.A.F. (ed.).
The molecular and cellular biology of wound repair.
2.ed. New York, Plenum Press, 1996. cap. 16,
p. 493-512.
30. EHRLICH, H.P.; HUNT, T.K. Effects of cortisone and vitamin A on
wound healing. Ann. Surg., v. 167, p. 324-8,1968.
31. EHRLICH, H.P.; HUNT, T. K. The effects of cortisone and anabolic
steroids on the tensile strength of healing wounds.
Ann. Surg., v. 170, p. 203-6, 1969.
32. EHRLICH, H.P.; TARVER, H.; HUNT, T.K. Effects of vitamin A
and glucocorticoids upon inflammation and collagen synthesis.
Ann. Surg., v.177, p. 222-7, 1973.
33. EUBANKS, T.R.; GREENBERG, J.J.; DOBRlN, P.B.; HARFORD,
F.J.; GAMELLI, R.L. The effects of different corticosteroids on the
hea1ing co1on anastomosis and cecum in a rat mode1.
Am. Surg., v. 63, p. 266-9, 1997.
34. FAUCI, A.S.; DALE, D.C.; BALOW, J .E. G1ucocorticosteroid
therapy: mechanisms of action and c1inica1 considerations.
Ann. Intem.Med., v. 84, p. 304-15, 1976.
35. FIELDING, L.P.; STEWART-BROWN, S.; BLESOVSKY, L.; KEARNEY,
G. Anastomotic integrity after operations for 1arge-bowe1 cancer:
a mu1ticentre study. Br. Med. J., v. 281, p. 411-4, 1980.
36. FLOWER, R.J.. G1ucocorticoids and the inhibition of phospho1ipase
A2. In: SCHLEIMER, R.P.; CLAMAN, H.N.; ORONSKY, A.L. (ed.).
Anti: inflammatory steroid action: basic and cinica1 aspects.
San Diego, Ca1ifomia, Academic Press,
1989. cap. 3, p. 48-66.
37. FORREST, L. Current concepts in soft connective tissue wound
hea1ing. Br. J. Surg., v. 70, p. 133-40, 1983.
38. FURST, M.B.; STROMBERG, B.V.; BLATCHFORD, G.J.;
CHRISTENSEN, M.A.; THORSON, A.G. Co1onic anastomosis: bursting strenght
after corticosteroid treatment. Dis. Co1on Rectum,
v. 37, p. 12-5, 1994.
39. GENNARI, C. Differential effect of glucocorticoids on calcium
absorption and bone mass. Br. J. Rheumatol.,
v. 32, p. 11-4, 1993. Suppl. 2.
40. GENNARI, C.; IMBIMBO, B. Effects of prednisone and def1azacort
on vertebral bone
ass. Calcif. Tissue, v. 37, p. 592-3,1985.
41. GILMOUR, D.G.; AITKENHEAD, A.R.; HOTHERSALL,
A.P.; LEDINGHAM, I. M. The effect of hypovolaemia on colonic blood f1ow
in the dog. Br. J. Surg., v. 67, p. 82-4,1980.
42. GOBBI, M; SCUDELETTI, M. Def1azacort in the treatment of
haematologic disorders. Eur. J. Clin. Pharmacol.,
v. 45, p. S25-8, 1993. Suppl. 1.
43. GOLIGHER, J.C.; GRAHAM, N.G.; DOMBAL, F.T.de.
Anastomotic dehiscence after anterior resection of rectum and sigmoid.
Br. J. Surg., v. 57, p.109-18, 1970.
44. GRAY, R.E.S.; DOHERTY, S.M.; GALLOWAY, J.; COULTON, L.;
BROE, M.de; KANIS, J .A. A double-blind study of deflazacort and
prednisone in patients with chronic inflammatory disorders.
Arthritis Rheum., v. 34, p. 287-95, 1991.
45. HADDAD, M. T. Tratamento clínico das doenças inflamatórias
intestinais. In: HABR-GAMA, A. (ed.). Doenca inflamatória intestinal.
São Paulo, Atheneu, 1997. cap. 9, p. 89-110.
46. HALSTED, W .S. Circular suture of the intestine: an experimental
study. Am. J. Med. Sci., v. 94, p. 436-61, 1887.
47. HANAUER, S.B.; BAERT, F. Medical therapy of inflammatory
bowel disease. Med. Clin. North Am., v. 78, p. 1413-26, 1994.
48. HARDER, F .; VOGELBACH, P. Sing1e-layer end-on continuous suture
of colonic anastomosis. Am. J. Surg., v. 155, p. 611-4, 1988.
49. HARTMANN, M.; JONSSON, K.; ZEDERFELDT, B. Importance
of dehydration in anastomotic and subcutaneous wound healing:
an experimental study in rats. Eur. J. Surg.,
v. 158, p. 79-82, 1992.
50. HARVEY, W.; GRAHAME, R.; PANAYI, G.S. Effects of steroid
hormones on human fibroblasts in vitro. I. Glucocorticoid action on cell growth
and collagen synthesis. Ann. Rheum. Dis., v. 33, p. 437-41, 1974.
51. HASTINGS, J.C.; V AN WINKLE Jr., W.; BARKER, E.; HINES,
D.; NICHOLS, W. Effect of suture materiaIs on hea1ing wounds of the
stomach and colon. Surg. Gynecol. Obstet., v. 140, p. 701-7,1975.
52. HAWLEY , P .R. Causes and prevention of co1onic
anastomotic breakdown. Dis.Co1on Rectum, v. 16, p. 272-7,1973.
53. HAWLEY, P.R.; HUNT, T.K.; DUNPHY, J.E. Etiology of colonic
anastomotic leaks. Proc. R. Soc. Med., v. 63, p.
28-30,1970a.
54. HAWLEY, P.R.; FAULK, W.P.; HUNT, T.K.; DUNPHY, J.E.
Collagenase activity in the gastro-intestinal tract.
Br. J. Surg., v. 57, p. 896-900, 1970b.
55. HAYNES Jr ., R.C. Adrenocorticotropic horrnone; adrenocortical
steroids and their synthetic analogs; inhibitors of the synthesis and actions
of adrenocortical hormones. In: GILMAN, A.G.; RALL, T.W.; NIES,
A.S.; TA YLOR, P. (ed.). The pharrnacological basis of therapeutics.
8.ed. New York, McGraw-Hill, 1990. cap. 60, p. 1431-62.
56. HENDRIKS, T.; MASTBOOM, W.J.B. Healing of experimental
intestinal anastomosis. Parameters for repair. Dis. Colon Rectum,
v. 33, p. 891-901, 1990.
57. HERRMANN, J.B.; WOODWARD, S.C.; PULASKI, E.J. Healing of
colonic anastomosis in the rat. Surg. G)::necol. Obstet.,
v. 119, p. 269- 75, 1964.
58. HESP, F.L.E.M.; HENDRIKS, T.; LUBBERS, E.C.; BOER, H.H.M.de.
Wound healing in the intestinal wall. Effects of infection on experimental ileal
and colonic anastomosis. Dis. Colon Rectum,
v. 27, p. 462- 7, 1984.
59. HlRATA, F. The role of lipocortins in cellular function as a
second messenger of glucocorticoids. In: SCHLEIMER, R.P.; CLAMAN,
H.N.; ORONSKY, A.L. (ed.). Anti-inflammatory steroid action: basic and
clinical asI2ects San Diego, California, Academic Press, 1989. cap. 4, p. 67-95.
60. HOGSTROM, H.; HAGLUND, U. Postoperative decrease in suture
holding capacity in laparotomy wounds and anastomosis.
Acta Chir. Scand., v. 151, p. 533-5, 1985.
61. HOUDART, R.; LAVERGNE, A.; VALLEUR, P.; VILLET,
R.; HAUTEFEUILLE, P. Vascular evo1ution of single-layer end-on
colonic anastomosis. A microangiographic study of 180 anastomosis in the
rat from two to 180 days. Dis. Colon Rectum,
v. 28, p. 475-80, 1985.
62. HOUSTON, K.A.; ROTSTEIN, O.D. Fibrin sealant in high-risk
colonic anastomosis. Arch. Surg., v. 123, p. 230-4, 1988.
63. HOWES, E.L.; PLOTZ, C.M.; BLUNT, J.W.; RAGAN, C. Retardation
of wound hea1ing by cortisone. Surgery, v. 28, p. 177-84, 1950.
64. IKEDA, S.; ITOH, H.; OOHATA, Y.; NAKAYAMA, F. Effect of a
new prostacyclin analogue on anastomosis of ischemic colon in dogs.
Dis. Colon Rectum, v. 31, p. 541-5, 1988.
65. IRVIN , T.T. Collagen metabolism in infected colonic anastomosis.
Surg. Gynecol. Obstet., v. 143, p. 220-4,1976.
66. IRVIN, T. T. Effects of malnutrition and hyperalimentation on
wound healing. Surg. Gynecol. Obstet., v. 146, p. 33-7, 1978.
67. IRVIN, T.T.; GOLIGHER, J.C. Aetiology of disruption of
intestinal anastomosis. Br. J. Surg., v. 60, p. 461-4, 1973.
68. IRVIN, T.T.; HUNT, T.K. Effect of malnutrition on colonic healing.
Ann. Surg., v. 180, p. 765-72, 1974.
69. JEX, R.K.; Van HEERDEN, J.A.; WOLFF, B.G.; READY, R.L.;
ILSTRUP, D.M. Gastrointestinal anastomosis: factors affecting early
complications. Ann. Surg., v. 206, p. 138-41, 1987.
70. JIBORN, H.; AHONEN, J.; ZEDERFELDT, B. Healing of
experimental colonic anastomosis. The effect of suture technic on
co1lagen concentration in the colonic wa1l. Am. J. Surg.,
v. 135, p. 333-40, 1978a.
71. JIBORN, H.; AHONEN, J.; ZEDERFELDT, B. Healing of
experimental colonic anastomoses. I. Bursting strength of the colon after left
colon resection and anastomosis. Am. J. Surg.,
v. 136, p. 587-94, 1978b.
72. JIBORN, H.; AHONEN, J.; ZEDERFELDT, B. Healing of
experimental .colonic anastomosis. II. Breaking strength of the colon after left
colon resection and anastomosis. Am. J. Surg.,
v. 136, p. 595-9, 1978c.
73. JIBORN, H.; AHONEN, J.; ZEDERFELDT, B. Healing of
experimental colonic anastomosis. III. Co1lagen metabolism in the colon after left
colon resection. Am. J. Surg., v. 139, p. 398-405, 1980.
74. KATZ, S.; IZHAR, M.; MIRELMAN, D. Bacterial adherence to
surgical sutures: a possible factor in suture induced infection.
Ann. Surg., v. 194, p. 35-41,1981.
75. KERR, H.H. The development of intestinal surgery. :JAMA, v.81, p.
641-7, Q 1923.
76. KHOURY, G.A.; WAXMAN, B.P. Large bowel anastomosis. I. The
healing process and sutured anastomosis. A review.
Br. J. Surg., v. 70, p. 61-3, 1983.
77. KIM, C.S.; BUCHMILLER, T.L.; FONKALSRUD, E.W.; PHILLIPS,
J.D. The effect of anabolic steroids on ameliorating the adverse effects
of chronic corticosteroids on intestinal anastomotic healing in rabbits.
Surg. Gynecol. Obstet., v. 176, p. 73-9, 1993.
78. KIM, Y.S.; KIM, M.S.; KIM, S.I.; LIM, S.K.; LEE, H.Y.; HAN, D.S.;
PARK, K. Post-transplantation diabetes is better controlled after conversion
from prednisone to def1azacort: a prospective trial in renal transplants.
Transpl. lnt, v. 10, p. 197-201, 1997.
79. KISS, D.R.; BOCCHINI, S.F.; NAHAS, P.; VASCONCELOS, E.
Anastomose em plano único de sutura na cirurgia cólica eletiva.
Rev. Paul. Med., v. 87, p.64-6, 1976.
80. KLEIN, L.; CHANDRARAJAN, J. Collagen degradation in rat skin but
not in intestine during rapid growth: effect on collagen types I and III
from skin. Proc. Natl. Acad. Sci. USA, v. 74, p. 1436-9,1977.
81. KLOPPER, P.J. Collagen in surgical research.
Eur. Surg. Res., v. 18, p. 218-23, Q 1986.
82. KOOB, T.J.; JEFFREY, J.J.; EISEN, A.Z. Regurgitation of human
skin collagenase activity by hydrocortisone and dexamethasone in
organ culture. Biochem. Biophys. Res. Comrnun.,
v. 61, p. 1083-8, 1974.
83. KOTZE, L.M.S.; PAROLIN, M.B. Doenças inflamatórias intestinais
na criança. In: HABR-GAMA, A. (ed.). Doenca inflamatória intestinal.
São Paulo, Atheneu, 1997. cap. 6, p. 41-67.
84. LEITE, C.V.S.; NARESSE, L.E.; KOBAYASI, S.; MINOSSI, J.G.;
BURINI, R.C.; CURI, P.R.; HOSSNE, W.S. Efeito da desnutrição proteica
na anastomose do cólon distal no rato. Estudo da força de ruptura e
do colágeno tecidual. Acta Cir. Bras.,
v. 8, n. 4, p. 145-50, 1993.
85. LEWIS, G.P. A review. Prostaglandins in inflammation.
J. Reticuloendothel. Soc., v. 22, p. 389-402,1977.
86. LEWIS, G.P; JUSKO, W.J.; BURKE, C.W.; GRAVES, L. Prednisone
side- effects and serum-protein levels. Lancet,
v. 2, p. 778-81, 1971.
87. LINDSTRÖM, C.G.; ROSENGREN, J.E.; FORK, F.T. Colon of the rat.
An anatomic, histologic and radiographic investigation.
Acta Radiol. Diagn., v.20, p. 523-36, 1979.
88. LIPPUNER, K.; CASEZ, J.P.; HORBER, F.F.; JAEGER, P. Effects
of deflazacort versus prednisone on bone mass, body composition, and
lipid profile: a randomized, double blind study in kidney transplant patients.
J. Clin. Endocrinol. Metab., v. 83, p. 3795-802, 1998.
89. LOCASCIO, V.; BALLANTI, P.; MILANI, S.; BERTOLDO, F.;
LOCASCIO, C.; ZANOLIN, E.M.; BONUCCI, E. A histomorphometric
long-term longitudinal study of trabecular bone loss in
glucocorticoid-treated patients: prednisone versus deflazacort.
Calcf. Tissue Int., v. 62, p. 199-204, 1998.
90. LOFTUS, J.; ALLEN, R.; HESP, R.; DAVID, J.; REID, D.M.; WRIGHT,
D.J.; GREEN, J.R.; REEVE, J.; ANSELL, B.M.; WOO, P.M. Randomized,
double-blind trial of deflazacort versus prednisone in juvenile chronic
(or rheumatoid) arthritis: a relatively bone-sparing effect of
deflazacort. Pediatrics, v. 88, p. 428-36, 1991.
91. LORD, M.G.; VALIES, P.; BROUGHTON, A.C. A morphologic study
of the submucosa of the large intestine. Surg. GY!1ecol. Obstet.,
v. 145, p. 55-60, 1977.
92. LUND, B.; EGSMOSE, C.; JORGENSEN, S.; KROGSGAARD,
M.R. Establishment of the relative antiinflammatory potency of deflazacort
and prednisone in polymyalgia rheumatica. Calcif. Tissue Int.,
v. 41, p. 316-20, 1987.
93. MANTOVANI, M.; LEONARDI, L.S.; ALCÂNTARA, F .G.de
Evolução da cicatrização em anastomoses do intestino grosso em condições
de normalidade e sob a ação de drogas imunossupressoras:
estudo comparativo em cães. Rev. Paul. Med.,
v. 94, p. 118-26, 1979.
94. MARKHAM, A.; BRYSON, H.M. Deflazacort. A review of
its pharmacological properties and therapeutic efficacy.
Drugs, v. 50, p. 317 - 33, 1995.
95. MAST, B.A. Healing in other tissues.
Surg. Clin. North Am., v. 77, p. 529-47, 1997.
96. MASTBOOM, W.J.B.; HENDRIKS, T.; Van ELTEREN, P.; BOER,
H.H.M.de. .The influence of NSAIDs on experimental intestinal anastomosis.
Dis. Colon Rectum, v. 34, p. 236-43, 1991a.
97. MASTBOOM, W.J.B.; HENDRIKS, T.; MAN, B.M.de; BOER,
H.H.M.de. Influence of methylprednisolone on the healing of intestinal
anastomosis in rats. Br. J. Surg., v. 78, p. 54-6, 1991b.
98. MATSUSUE, S.; WALSER, M. Healing of intestinal anastomosis
in adrenalectomized rats given corticosterone. Am. J. Physiol.,
v. 263, p.164- 8, 1992.
99. MEDUGORAC, I. Collagen content in different areas of normal
and hypertrophied rat myocardium. Cardiovasc. Res.,
v. 14, p. 551-4, 1980.
100. MESSINA, O.D.; BARREIRA, J.C.; ZANCHETTA, J.R.;
MALDONADO- COCCO, J.A.; BOGADO, C.E.; SEBASTIAN, O.N.; FLORES,
D.; RIOPEDRE, A.M.; REDONDO, G.; LAZARO, A. Effect of low doses
of deflazacort vs prednisone on bone mineral content in
premenopausal rheumatoid arthritis. J. Rheumatol.,
v. 19, p. 1520-6, 1992.
101. MICHENER, W.M.; WYLLIE, R. Management of children and
adolescents with inflammatory bowel disease. Med. Clin. North Am.,
v. 74, p. 103-17, 1990.
102. MILLER, E.J. Biochemical characteristics and biological significance of
the genetically-distinct collagens. MoI. Cell. Biochem.,
v. 13, p. 165-92, 1976.
103. MILSOM, J.W.; SENAGORE, A.; WALSHAW, R.K.; MOSTOSKY,
U.V.; WANG, P.; JOHNSON, W; CHAUDRY, I.H. Preoperative radiation
therapy produces an early and persistent reduction in colorectal anastomotic
blood flow. J. Surg. Res., v. 53, p. 464-9, 1992.
104. MORGENSTERN, L.; YAMAKAWA, T.; BEN-SHOSHAN, M.;
LIPPMAN, H. Anastomotic leakage after low colonic anastomosis: clinical
and experimental aspects. Am. J. Surg., v. 123, p.104-9, 1972.
105. MORGENSTERN, L.; SANDERS, G.; WAHLSTROM, E.; YADEGAR,
J.; AMODEO, P. Effect of preoperative irradiation on healing of low
colorectal anastomosis. Am. J. Surg., v.147, p. 246-9,1984.
106. NARESSE, L.E.; LEITE, C.V.S.; RODRIGUES, M.A.M.; ANGELELI,
A.Y.O.; MINOSSI, J.G.; KOBA Y ASI, S. Efeito da peritonite fecal na
cicatrização do cólon distal no rato. Avaliação anatomopatológica, estudo da força
de ruptura e da hidroxiprolina tecidual. Acta Cir. Bras.,
v. 8, p. 48-53, 1993.
107. NELSEN, T.S.; ANDERS, C.J. Dynamic aspects of small intestinal
rupture with special consideration of anastomotic strength.
Arch. Surg., v. 93, p. 309-14, 1966.
108. OLIVEIRA, P.G. Estudo dos efeitos de uma prostaglandina sintética.
o misoprostol. sobre a cicatrização de anastomoses no intestino grosso
de ratos. Ribeirão Preto, 1989. 102p. Dissertação (Mestrado) -Faculdade
de Medicina de Ribeirão Preto, Universidade de São Paulo.
109. OLIVEIRA, P .G. Efeitos da peritonite por
Candida albicans na
cicatrização de anastomoses colônicas:
estudo experimental em ratos. Ribeirão
Preto, 1995. 119p. Tese (Doutorado) - Faculdade de Medicina de Ribeirão
Preto, Universidade de São Paulo.
110. OLIVEIRA, P.G.; SOARES, E.G.; APRILLI, F. Inf1uence of misoprostol,
a synthetic prostaglandin E 1 analog, on the healing of colonic
anastomosis in rats. Dis. Colon Rectum, v. 37, p. 660-3, 1994.
111. ORMISTON, M.C. A study of rat intestinal wound healing in the
presence of radiation injury. Br. J. Surg.,
v. 72, p. 56-8, 1985.
112. PAGANO, G.; LOMBARDI, A.; FERRARIS, G.M.; IMBIMBO,
B.; CAVALLO-PERIN, P. Acute effect of prednisone and def1azacort
on glucose tolerance in prediabetic subjects. Eur. J. Clin. Pharmacol.,
v. 22, p. 469-71,1982.
113. PEREIRA, F.E.L. Degenerações. Morte celular. Alterações do
interstício. In: BOGLIOLO, L. (ed.). Patologia geral.
Rio de Janeiro, Guanabara Koogan, 1993. cap. 4, p.45-88.
114. PÉREZ- TAMAYO, R. Pathology of collagen degradation. A
review. Am.J.Pathol., v. 92, p. 509-66, 1978.
115. PHILLIPS, J.D.; KIM, C.S.; FONKALSRUD, E.W.; ZENG, H.; DINDAR,
H. Effects of chronic corticosteroids and vitamin A on the healing of
intestinal anastomosis. Am. J. Surg., v. 163, p. 71-7,1992.
116. PRICE, L.A. The effect of systemic steroids on ileorectal anastomosis
in ulcerative colitis. Br. J. Surg., v. 55, p. 839-40, 1968.
117. PROCKOP, D.1.; KIVlRIKKO, K.I. Collagens: molecular biology,
diseases, and potentials for therapy. Annu. Rev. Biochem.,
v. 64, p. 403-34,1995.
118. RAVITCH, M.M.; BROLIN, R.; KOL TER,
I.; y AP, S. Studies in the healing of intestinal anastomosis.
World I. Surg., v. 5, p. 627-37,1981.
119. RAVO, B. Colorectal anastomotic healing and intracolonic
bypass procedure. Surg. Clin. North Am., v. 68, p. 1267-94, 1988.
120. REGAZZINI, R.C.de o. Efeitos do 5-fluorouracil na cicatrização
de anastomoses colônicas: estudo experimental em ratos. Ribeirão Preto,
1996. 66p. Dissertação (Mestrado) -Faculdade de Medicina de Ribeirão
Preto, Universidade de São Paulo.
121. RIZZATO, G.; RIBOLDI, A.; IMBIMBO, B.; TORRESIN, A.; MILANI,
S. The long-term efficacy and safety of two different corticosteroids
in chronic sarcoidosis. Resnir. Med., v. 91, p. 449-60, 1997.
122. ROCHA, 1.1 .R. da. Estudo comparativo entre sutura contínua e
sutura com pontos senarados em anastomoses colo-cólicas em plano
único: trabalho experimental em cães. Ribeirão Preto, 1989. 113p.
Tese (Doutorado) - Faculdade de Medicina de Ribeirão Preto,
Universidade de São Paulo.
123. SANDBERG, N. Time relationship between administration of
cortisone and wound healing in rats. Acta Chir. Scand.,
v. 127, p. 446-55, 1964.
124. SCHIMMER, B.P .; P ARKER, K.L. Adrenocorticotropic
hormone; adrenocortical steroids and their synthetic analogs; inhibitors of
the synthesis and actions of adrenocortical hormones. In: GILMAN,
A.G.; HARDMAN, J.G.; LIMBIRD, L.E. (eds.). Goodman & Gilman's
The pharmacological basis of therapeutics. 9.ed. New York, McGraw-Hill,
1996. cap. 59, p. 1459-85.
125. SCHROCK, T.R.; DEVENEY, C.W.; DUNPHY, J.E. Factors contributing
to leakage of colonic anastomosis. Ann.
Surg., v. 177, p. 513-8, 1973.
126. SCUDELETTI, M.; PUPPO, F.; LANZA, L.; MANTOV ANI, L.;
BOSCO, O.; .IUDICE, A.; IMBIMBO, B.; INDIVERI, F. Comparison of
two glucocorticoid preparations (deflazacort and prednisone) in the
treatment of immune-mediated diseases. Eur. J. Clin.
Pharmacol., v. 45, p. S29-34, 1993. Suppl. 1.
127. SHERIDAN, W.G.; LOWNDES, R.H.; YOUNG, H.L. Tissue oxygen
tension as a predictor of colonic anastomotic healing.
Dis. Colon Rectum, v .30, p. 867-71, 1987.
128. SIRIMARCO, M. T .Efeitos do deflazacort na cicatrização de
anastomoses colônicas: estudo experimental em ratos. Ribeirão Preto, 1998. 99
p. Dissertação (Mestrado) - Faculdade de Medicina de Ribeirão
Preto, Universidade de São Paulo.
129. SIRIMARCO, M.T.; ZUCOLOTO, S.; APRILLI, F.
Efeitos do deflazacort na cicatrização de anastomoses
colônicas: estudo experimental em ratos.
Rev. Bras. Colo-Proct., v. 19, p. 35-51, 1999.
130. SKAKUN, G.B.; REZNICK, R.K.; BAILEY, H.R.; SMITH, K.W.; MAX,
E. The single-layer continuous polypropylene colon anastomosis.
A prospective assessment using water-soluble contrast enemas.
Dis. Colon Rectum, v. 31, p. 163-8, 1988.
131. SOARES, E.P. Efeitos do ácido 5-aminossalicílico na cicatrização
de anastomoses colônicas: estudo experimental em ratos. Ribeirão Preto,
1996. 70p. Dissertação (Mestrado) - Faculdade de Medicina de Ribeirão
Preto, Universidade de São Paulo.
132. SOUSA, J .B. Estudo da cicatrização em anastomoses no intestino
delgado de coelhos tratados com diclofenaco
sódico. Ribeirão Preto, 1989.
104p. Dissertação (Mestrado) - Faculdade de Medicina de Ribeirão
Preto, Universidade de São Paulo.
133. SOUSA, J .B. Evolucão da cicatrizacão de anastomoses colônicas sob
a ação do diclofenaco sádico administrado no período
perioperatório: estudo experimental em coelhos. Ribeirão Preto, 1994. 95p. Tese (Doutorado)
- Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo.
134. STEED, D.L. The role of growth factors in wound healing.
Surg. Clin. North Am., v. 77, p. 575-86,1997.
135. STEGEMANN, H.; STALDER, K. Determination of hydroxyproline.
Clim. Acta, v. 18, p. 267-73,1967.
136. STEIN, R.B.; HANAUER, S.B. Medical therapy for inflammatory
bowel disease. Gastroenterol. Clin. North Am.,
v. 28, p.297-321, 1999.
137. STEW ART , R. Influence of malignant cells on the healing of
colonic anastomosis: experimental observations.
Proc. R. Soc. Med., v. 66, p.1089- 91,1973.
138. SWARTZ, S.L.; DLUHY, R.G. Corticosteroids: clinical and
therapeutic use. Drugs, v. 16, p. 238-55,1978.
139. THORNTON, F.J.; BARBUL, A. Healing in the gastrointestinal tract.
Surg. Clin. North Am., v. 77, p. 549-73,1997.
140. VANE, J.R.; BOTTING, R.M. New insights into the mode of action of
anti-inflammatory drugs. Inflamm. Res., v. 44, p. 1-10, 1995.
141. VIANNA, A.L.; DUARTE, V.T.; ARAUJO, R.C.; BARBOSA, H. Uremia
e cicatrização intestinal: estudo experimental em ratos.
Rev. Hosp. Clin. Fac. Med. São Paulo,
v. 36, p. 27-30,1981.
142. WISE, L; McALISTER, W.; STEIN, T.; SCHUCK, P. Studies on the
healing of anastomosis of small and large intestines.
Surg. Gynecol. Obstet., v. 141, p.190-4, 1975.
143. WITTE, M.B.; BARBUL, A. General principles of wound hea1ing.
Surg. Clin. North Am., v. 77, p. 509-28,1997.
144. YAMAKAWA, T.; PATIN, C.S.; SOBEL, S.; MORGENSTERN, L.
Healing of colonic anastomosis following resection for experimental
"diverticulitis". Arch.Surg., v. 103, p. 17-20, 1971.
Endereço para correspondência:
Mauro Toledo Sirimarco
Rua Marechal Deodoro, 541 sala 314
36013-001 Juiz de Fora, MG



















