|
|
| Fig 1 Estiramento antero-posterior do canal anal para identificação da musculatura esfincteriana |
ARTIGOS ORIGINAIS
Fábio Guilherme C. M. de Campos - TSBCP
Sérgio Eduardo ALONSO Araújo - TSBCP
Angelita Habr-Gama - TSBCP
RESUMO: Esta revisão visou enfocar aspectos relacionados à patogênese e ao tratamento cirúrgico das fissuras anais, ressaltando os resultados relacionados à cicatrização e continência no pós-operatório. A fissura anal é doença proctológica freqüente, de etiologia ainda não completamente definida, associada a aumento na pressão basal do esfíncter interno do ânus (EIA), a traumatismos no canal anal e à diminuição da perfusão da anoderme na comissura posterior. O tratamento cirúrgico baseia-se na realização de esfincterotomia que visa reduzir a pressão de repouso do EIA e impedir a contração reflexa após a passagem das fezes. Historicamente, a realização de esfincterotomia evoluiu da posição mediana posterior para a posição lateral (para diminuir a ocorrência de escape fecal no pós-operatório) e da técnica aberta para fechada (para diminuir a dor e a área cruenta). Embora a esfincterotomia interna seja efetiva no controle dos sintomas e na cicatrização da fissura em mais de 95% dos pacientes, relata-se incontinência fecal minor no período pós-operatório precoce em grande número de pacientes, geralmente auto-limitada e transitória. Felizmente, deficiência permanente ou grave ocorre em menos de 1% dos casos. Dentro deste contexto, pacientes com alto risco para desenvolver distúrbios da continência poderão ser tratados com o uso tópico com doadores de óxido nítrico ou procedimentos cirúrgicos alternativos, como o uso de retalhos de pele. A associação de estudos eletromanométricos aos dados de exame físico poderá auxiliar na seleção dos pacientes que se beneficiariam dessas formas de tratamento.
Unitermos: fissura anal, esfincterotomia, incontinência anal.
A fissura anal é uma afecção proctológica comum
que causa dor aguda, sofrimento e desconforto maior que
qualquer outra lesão de seu tamanho no corpo humano
38 . A dor durante e após a evacuação, causada pela rica
inervação somática da anoderme, dura de minutos a horas e
é freqüentemente acompanhada de sangramento
observado sobre as fezes ou no papel higiênico. O paciente
torna-se, então, apreensivo sobre futuras evacuações, relutância
que aumenta a constipação e o desconforto. Prurido anal
pode se desenvolver como resultado da descarga de muco
da ferida na pele perianal ou de uma fístula associada.
Sua etiologia é multifatorial, reconhecendo-se o
importante papel do trauma evacuatório e da hipertonia do
músculo esfíncter interno do ânus (EIA) em sua
patogênese. Predomina no sexo feminino e ocorre em todos os
grupos etários, com maior incidência na 3ª e 4ª décadas, sendo
menos freqüentemente diagnosticada em crianças e idosos
31 .
Localiza-se principalmente na linha mediana
posterior (66 a 86%), embora lesões anteriores não sejam raras
em homens (1%) e principalmente nas mulheres (10%)
20. A localização anterior nas mulheres é geralmente
conseqüência de ruptura do epitélio de revestimento do canal
anterior durante partos prévios. Podem se desenvolver também
nas paredes laterais (4,5%), cuja localização deve levantar
a suspeita de lesão não idiopática.
A cronicidade das fissuras é indicada pela presença
de plicoma sentinela distal, da papila hipertrófica e
pela visualização de fibras do EIA em sua base. As
técnicas cirúrgicas utilizadas em seu tratamento contemplam a
redução da pressão de repouso do EIA por meio de
diferentes formas de esfincterotomia.
Nesta revisão serão enfocados aspectos históricos e
técnicos relacionados à patogênese e ao tratamento
cirúrgico das fissuras anais, ressaltando os resultados da
literatura quanto aos índices de cicatrização e complicações
relativas à continência.
etiopatogênese
Apesar dos numerosos esforços para elucidar a
causa das fissuras anais ao longo dos anos, ainda não se
estabeleceu uma teoria etiológica unificadora. A teoria mais
antiga sugere que o evento inicial das fissuras primárias é
representado por uma pequena lesão traumática na
anoderme, que ocorre durante a passagem de fezes endurecidas
resultantes de constipação ou fezes de consistência normal
em indivíduo com aumento da freqüência das evacuações.
Já as fissuras secundárias podem estar relacionadas
a fatores iatrogênicos (pós cirurgia ano-retal), trauma
local direto (homossexualismo, prurido anal), estenose anal,
fatores constitucionais (subluxação ou protusão
esfincteriana), doenças inflamatórias intestinais e doenças infecciosas
38 .
Características anatômicas do canal anal foram
associadas à predominância das fissuras anais na linha
mediana posterior. Em 1914, Lockhart Mummery
26 atribuiu este fato à configuração ovóide das fibras do músculo
esfíncter externo do ânus (EEA), dando suporte junto às
paredes laterais e criando uma deficiência posterior da
anoderme. Blaisdell 5 relatou em 1937 que, enquanto as fibras
distais do EEA circunscrevem completamente o ânus, as
fibras proximais se cruzam formando um "Y" posterior.
Segundo esta teoria, nesta área triangular existe menor
sustentação à anoderme, tornando-a mais susceptível ao
trauma. Dessa maneira, esse arranjo anatômico predisporia
a comissura posterior à lesão pelo trauma evacuatório
20 .
Apesar da maioria das teorias incriminarem o trauma
à anoderme como o fator iniciante, não está claro
porque algumas fissuras são rebeldes à cicatrização e se
tornam crônicas. Nas fissuras primárias, sugere-se que a
presença de inflamação crônica na pele perianal desencadeie a
liberação de enzimas colagenolíticas que reduzam a
resistência tênsil dos tecidos
38 . Este fato explicaria porque mesmo a passagem de fezes calibrosas de consistência
normal podem desenvolver fissura.
Estudos anatômicos e angiográficos demonstraram
também que as pressões esfincterianas elevadas do EIA
determinam diminuição da perfusão da mucosa do canal anal
na comissura posterior, enfatizando a hipótese de que
as fissuras anais são úlceras isquêmicas
21, 47, 48 .
Fissuras anais agudas compreendem soluções de
continuidade superficiais distais à linha pectínea,
apresentando margens definidas e assoalho caracterizado por fibras
verticais (extensões da musculatura longitudinal que passa
pelo EIA em direção à anoderme). Essas lesões são comuns
e freqüentemente cicatrizam espontaneamente, sendo
de pouca significância para o paciente.
Fissuras anais crônicas estão presentes por poucos
meses ou anos antes do paciente procurar ajuda médica, e
sua cicatrização sem intervenção cirúrgica é rara.
Caracterizam-se por úlcera bem definida, alterações
secundárias como bordos irregulares, base endurecida e fibrosa
(onde se notam fibras circulares do EIA expostas) e plicoma
sentinela (70% dos casos) em sua margem distal. Este é
constituído por pele redundante e espessada formada pela
regressão de edema. Na extremidade superior da
fissura, pode-se identificar uma lesão fibrosa (papila
hipertrófica) em porcentagem variável dos casos
25 .
Assim, verifica-se nas fissuras anais típicas a tríade
lesão ulcerada, papila hipertrófica e plicoma sentinela.
Às vezes um abscesso pode se formar abaixo do plicoma,
na forma de pequena fístula subcutânea, configurando
uma fissura fistulizada. Essas alterações, associadas à
fibrose que diminui a complacência do EIA, dificultam a
cicatrização da úlcera e requerem intervenção
cirúrgica (esfincterotomia associada à excisão da úlcera por
incisão elíptica que inclua o plicoma sentinela e a papila).
À manometria, fissuras crônicas freqüentemente se
associam a altas pressões anais de repouso, mais
provavelmente resultantes de um aumento real no tônus
basal (hipertonia) do que de espasmo do EIA 13, 14, 16,
40 . Os estudos eletromanométricos sugerem que os
aumentos pressóricos no canal anal são simétricos, globais e
precedem a cronificação da fissura, contribuindo para
a fisiopatologia desta afecção 13,
51.
Algumas características da lesão fissuróide
requerem outras considerações diagnósticas, como a
multiplicidade, a localização fora da axis ântero-posterior do canal anal
ou a extensão acima da linha pectínea.
Complicações perianais como abscessos, fístulas
e fissuras podem se desenvolver no curso da Doença
de Crohn. Em 66 pacientes com doença perianal, Sangwan
et al. 46 constataram que a fissura anal foi a terceira
lesão anoretal mais freqüente.
Nesta doença, as úlceras podem ser indolores em
mais de 50% dos pacientes, posteriores em apenas 70% e
múltiplas em 30% dos casos. Predominam em pacientes
com doença colônica e biópsias de suas bordas elevadas
podem confirmar o diagnóstico. A escarificação anal com
induração levam a estenose, muitas vezes assintomática devido
às fezes líqüidas. Essas fissuras podem cicatrizar
espontaneamente ou responder a medidas conservadoras.
A necessidade de fissurectomia ou esfincterotomia é
raramente considerada devido às preocupações quanto à
cicatrização deficiente e à morbidade esfincteriana em
pacientes com Doença de Crohn e diarréia crônica. Por outro
lado, fissuras rebeldes ao tratamento clínico podem
desenvolver abscessos e fístulas, requerendo a realização de
proctectomia. Deste modo, em pacientes selecionados, a
esfincterotomia lateral interna pode ser realizada com bons resultados.
Prurido anal crônico também pode ser responsável
pelo aparecimento de múltiplas fissuras, geralmente
associadas a dermatite perianal. No diagnóstico diferencial deve-se
lembrar ainda das lesões malignas ulceradas do canal
anal, muitas vezes indolores até que invadam a
musculatura, sendo reconhecidas pela palpação e aspecto macroscópico.
Introdução de objeto estranho, instrumentação cirúrgica
e força física são causas menos comuns de fissura anal.
Eventualmente, feridas cirúrgicas podem contribuir para a
formação de tecido cicatricial e subseqüente estenose do canal
anal, predispondo à formação de úlcera no canal anal. Fissuras
podem ainda se originar de cicatrização incompleta após
operações ano-retais, especialmente hemorroidectomias.
Embora raras nos dias atuais, a possibilidade de
sífilis, gonorréia ou tuberculose deve ser cogitada na presença
de fissuras múltiplas em pacientes de risco para doenças
sexualmente transmissíveis, como os portadores do vírus
HIV. Menos freqüente também é a fissura anal por tração,
produzida por lesões que prolapsam no momento da
evacuação, como hemorróidas de terceiro grau e pólipos.
Em crianças, fissuras anais podem ter etiologia
diferente da constipação, podendo resultar de arranhões
secundários a prurido ou de infestação por nematóides (oxiúros).
Tratamento Cirúrgico
Evolução Histórica
As técnicas operatórias usadas no tratamento das
fissuras incluem estiramento ou dilatação anal, esfincterotomia
posterior, esfincterotomia lateral (aberta ou fechada) e
cobertura da fissura com "flap" dérmico.
Historicamente, utilizaram-se inicialmente medidas
conservadoras empregadas no manuseio das fissuras
agudas, como repouso intestinal, dieta pobre em resíduos,
correção da constipação, uso de pomadas anestésicas locais,
soluções de nitrato de prata e higiene local com banhos de assento
3 .
No começo do século, Charles E. Blanchard
da Cleveland Clinic (apud Saclarides; Brand
44) já defendia que o tratamento das fissuras "não deve ser
magnificado; pois não é uma condição que requeira uma operação
radical, podendo ser tratada por procedimentos
ambulatoriais". Este autor desprezava tanto a realização de incisão,
considerada uma "mutilação desnecessária do ânus e uma
maneira cara de obter relaxamento", como a excisão da
fissura, por "causar úlcera maior que a original".
Blanchard defendia a realização de divulsão ou
estiramento esfincteriano, descrita em 1838 por Récamier
41 , baseando-se na premissa de que a dor prolongada era devida a
espasmo esfincteriano. A dilatação consistia na introdução de
dois ou mais dedos indicadores lubrificados aplicados em
direção oposta, fazendo-se pressão durante alguns minutos,
evitando-se movimentos rápidos prevenir trauma esfincteriano.
Entretanto, para a maioria dos cirurgiões, a
divulsão por estiramento bimanual foi abandonada pelo fato de
determinar lesão de tecido não
predictível e maiores índices de recidiva comparados à esfincterotomia
30 .
Na maioria dos centros, o tratamento cirúrgico incluía
a excisão da úlcera por meio de incisão elíptica englobando
o plicoma. Reportes eventuais sugeriam a realização de
incisão (sem excisão) do ápice da fissura até a pele,
incluindo-se a violação de uma porção do EIA nesta manobra,
embora se desconhecesse o real significado desta manobra
44.
Embora desprovida de base fisiopatológica conhecida,
a esfincterotomia já era praticada desde 1818 por Boyer.
Em 1930 Gabriel sugeriu excisão da fissura e secção parcial
do músculo que erroneamente acreditava ser a porção
inferior do esfíncter externo. Em 1936 Miles relatou alívio da dor
e cicatrização da ferida anal após secção da "banda
pectínea espessada". Desta maneira, a experiência ao longo dos
anos demonstrou que alguma forma de esfincterotomia é
necessária para tratar as fissuras anais crônicas
28 .
A divulgação da esfincterotomia posterior começou
na metade do século por Eisenhammer
8 em 1951, que demonstrou que o assoalho da fissura é formado pelo
EIA. Entretanto, coube a Morgan e Thompson
29 em 1956 a padronização desta técnica, descrevendo a divisão do
EIA através do leito da fissura desde a linha denteada até
sua borda inferior, estendendo-se a incisão até a pele
perianal com divisão superficial da parte subcutânea do EEA,
com o objetivo de melhorar a drenagem local, deixando-se
a ferida aberta.
A associação de fissurectomia e esfincterotomia
posterior era considerada a operação de escolha, pois retirava
a papila inflamada. Embora os índices de recidiva
fossem baixos, relataram-se complicações pós-operatórias
menores como incontinência para gases e escapes fecais em 5
a 34% dos pacientes 1, 4, 15 . Essas complicações foram
creditadas ao fechamento incompleto da metade inferior do
canal anal, criando uma deformidade chamada de "ânus
em buraco de fechadura" 28 , onde fezes ficam retidas e
são eventualmente eliminadas, sujando as vestes íntimas.
Entretanto, desde a introdução da esfincterotomia,
tornou-se óbvio que a divisão do EIA não é inócua,
determinando alterações da continência em alguns pacientes.
Apesar disso, a esfincterotomia posterior é utilizada em
muitos centros. Em nosso meio, Nahas et al
31 não identificaram a ocorrência de incontinência anal em 220 pacientes
operados por fissura crônica.
Visando minimizar as complicações pós-operatórias,
a esfincterotomia interna evoluiu da posição posterior para
a lateral 4, 10, 39 e da técnica aberta para fechada
35 .
Muitos cirurgiões, inclusive Eisenhammer
8, 10 , modificaram sua opção original em favor da esfincterotomia
lateral aberta, ao observar que a secção do EIA em posição
lateral, longe da fissura, permite sua cicatrização e determina
menor índice de distúrbios funcionais (escape ou
"soiling" fecal) em relação à esfincterotomia posterior
9, 17, 19 .
Essas observações propiciaram a difusão da prática
da esfincterotomia lateral realizada sob visão direta ou
aberta (Parks 39) ou "às cegas" pela técnica submucosa
fechada (Notaras 33, 34, 35), cujos resultados foram comparados
com a esfincterotomia posterior em trabalhos subseqüentes.
Aspectos da Técnica Operatória
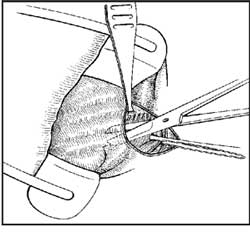
A esfincterotomia lateral aberta inicia-se com a
introdução de afastador bivalvar em sentido ântero-posterior
para estiramento do EIA (Figura 1). Este é então exposto
por meio de incisão radial de 2-3 cm na pele perianal logo
abaixo de sua borda inferior, apreendendo-o com pinça de
Allis para facilitar a dissecção romba até a linha pectínea. A
identificação do EIA é feita pela coloração mais
esbranquiçada de suas fibras em relação à coloração mais avermelhada
das fibras da parte subcutânea do EEA. Assim, o EIA exposto
é seccionado numa extensão de 1 a 2 cm com bisturi ou
tesoura, deixando-se a ferida aberta para drenagem
(Figuras 2A e 2B). Sir Alan Parks 39 realizava incisão circular
lateral, que era fechada com pontos separados.
|
|
| Fig 1 Estiramento antero-posterior do canal anal para identificação da musculatura esfincteriana |
 |
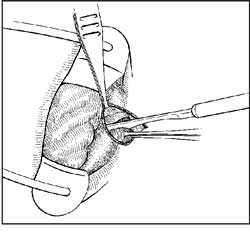 |
| Fig 2 Esfincterotomia lateral interna pela técnica aberta: identificação e apreensão da borda inferior EIA, com dissecção entre a anoderme e o músculo (A); secção muscular com bisturi ou tesoura (B). | |
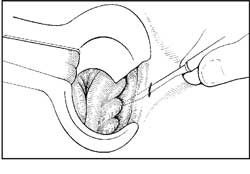
Outra opção técnica para divisão do EIA é
representada pelo acesso subcutâneo "fechado", em que se evita
a confecção de uma ferida larga para sua identificação.
Coube a Notaras 33 a introdução e divulgação desta técnica.
O procedimento pode ser realizado sob anestesia
local e em regime ambulatorial, com o paciente em posição
de litotomia, e consiste em realizar uma secção lateral (3h
ou 9h) no EIA. Isto é facilitado pela introdução de um
afastador de Eisenhammer, Fergusson-Hill, Parks ou Pitanga
Santos, que permitem identificar o EIA como uma banda
estirada. Após infiltração local no espaço interesfinctérico
e sob a mucosa do canal anal, introduz-se lâmina de
bisturi estreita (número 11) entre a anoderme e o EIA até a
linha pectínea, atingindo-se o EIA "às cegas". Em seguida
vira-se a lâmina em direção ao EIA, que é seccionado
conforme a lâmina é retirada (Figuras 3A e 3B).
 |
 |
| Fig 3 Esfincterotomia lateral interna pela técnica fechada: introdução do bisturi na pele perianal entre o epitélio do canal anal e o EIA até a altura da linha pectínea (A), e rotação da lâmina para realizar a esfincterotomia (B). | |
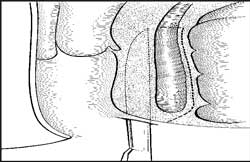
Uma variante da técnica subcutânea fechada consiste
em introduzir a lâmina entre o EEA e o EIA e fazer
a esfincterotomia dividindo-se o músculo em direção à
anoderme 19 (Figura 4). A ferida cutânea, em ambos os casos, é
deixada aberta para drenagem, uma vez que é pequena.
A realização da fissurectomia posterior não é
obrigatória, mas uma papila hipertrófica ou plicoma sentinela
volumosos podem ser retirados simultaneamente. Na
presença de mamilos hemorroidários, sua exérese é aconselhável
para evitar o prolapso hemorroidário que pode ocorrer após
a esfincterotomia.
|
|
|
Fig 4 Esfincterotomia lateral interna pela técnica fechada. Inserção do bisturi entre o EIA e o EEA e secção muscular do EIA controlada pela sensação digital na mucosa do canal anal. |
Resultados da Literatura
Em estudo prospectivo comparando dilatação
anal, esfincterotomia posterior e lateral, Hawley
17 concluiu que a última técnica era a melhor opção, resultando em
cicatrização mais rápida, menos dor e menor persistência
dos sintomas (0 vs. 8%). Em 1970, Hoffmann e Goligher
19 observaram ausência de cicatrização em apenas 2% de
103 doentes submetidos à esfincterotomia lateral
subcutânea após 9 meses.
Em estudos desenvolvidos em nosso meio, Fraiha et
al 12 não observaram recidiva da fissura pós
esfincterotomia lateral. Nahas et al 31 não identificaram a ocorrência
de incontinência anal em 220 pacientes operados por
fissura crônica e observou-se recidiva em dois pacientes
(1,1%) de 184 submetidos a esfincterotomia posterior, e em
um paciente (2,9%) após esfincterotomia lateral (n = 34).
Em 150 pacientes tratados por esfincterotomia
lateral aberta, Abcarian 1 relatou 2 recidivas (1,3%). Lewis et al
24 reportaram persistência da lesão apenas 4,6% de 350
pacientes operados pelas técnicas fechada ou aberta,
registrando ainda incontinência minor transitória em 17% deles.
Realizando estudo por meta-análise das
publicações comparando as técnicas operatórias quanto à recidiva
das fissuras e incontinência para flatus, Nelson
32 encontrou superioridade da esfincterotomia sobre a dilatação
anal, sugerindo também a opção pela técnica lateral em
detrimento da posterior.
Em termos gerais, há concordância que as técnicas
de esfincterotomia lateral fechada e aberta determinam
redução similar nas pressões anais de repouso.
Estudos manométricos demostraram redução significante,
simétrica, global e duradoura dos níveis pressóricos no canal
anal 51 , com índices de cicatrização indistinguíveis em
estudos prospectivos e retrospectivos 6, 20, 22,
32 .
A esfincterotomia lateral resulta em cicatrização em
mais de 95% dos pacientes, podendo ser realizada
ambula-torialmente, com resultados reprodutíveis
1, 24, 37 . Entretanto, essa técnica não é livre de complicações, tendo-se
registrado índices de morbidade pós-operatória em 0,5 a 36% dos
pacientes e insucesso devido a esfincterotomia inadequada
6, 20, 24.
Infecção, sangramento são incomuns e
auto-limitados. Recidivas ou persistência da fissura foram descritas em 0
a 10% dos pacientes, variação que provavelmente reflete
diferenças na extensão da divisão muscular, na definição
de recidiva e no tempo de seguimento 6, 15, 20,
35 . Contudo, sabe-se que algumas recidivas cicatrizam com
tratamento clínico por manipulação farmacológica da consistência
das fezes e tratamento sintomático
38 .
Os problemas relacionados à continência são as
complicações mais sérias. Embora se reconheça que
distúrbios da incontinência ocorram transitoriamente no
pós-operatório precoce em até 30% dos pacientes
1, 11, 50, algumas revisões reportaram uma preocupante incidência de
formas menores de incontinência pós esfincterotomia interna
em 5% a 45 % dos pacientes a longo prazo 20,
37 .
Em inquérito por questionário sobre 829 pacientes
tratados por esfincterotomia interna, Khubchandani e Reef
20 observaram cicatrização em 97,7% após 6 semanas,
sem diferenças relacionadas à evolução ou déficits na
continência quando se comparam os submetidos a
esfincterotomia posterior, lateral ou bilateral. Déficits de continência
foram relatados "algumas vezes" ou "freqüentes" e incluíram
perda do controle de flatus (35%), escape fecal (22%) e
movimentos intestinais acidentais (5,3%).
Em 585 submetidos a esfincterotomia lateral (95%
aberta e 5% fechada), Nyam e Pemberton
37 reportaram cicatrização em 96% dos pacientes em três semanas, com
recidiva em 8%. Algum grau de incontinência ocorreu em
45% dos pacientes durante algum tempo no período
pós-operatório, principalmente no pós-operatório precoce, sendo
mais freqüente em mulheres (54% vs. 33%).
Do total de operados, incontinência para flatus ocorreu
em 31%, escape fecal em 39% e incontinência grosseira em
23% dos pacientes em algum momento após a operação.
Entretanto, na época do interrogatório (> 5 anos de seguimento),
esses eventos foram relatados em apenas 6%, 8% e 1%,
respectivamente. Nesta avaliação, somente 3% dos pacientes
relataram que a incontinência afetou sua qualidade de vida.
Destacam-se como desvantagens da técnica fechada
a incerteza da realização da esfincterotomia, lesão
inadvertida de vasos ou do EEA e formação de abscessos
com posterior fistulização, por propiciar ao cirurgião menor
controle técnico durante a divisão muscular
38 . Por outro lado, sugere-se que uma esfincterotomia mais completa é
obtida com a técnica aberta, tornando esta opção técnica
mais susceptível a alterações da continência, embora esta
propensão não consiga distinguir as duas técnicas.
Desde a descrição detalhada da técnica por Notaras
34 em 1969, a esfincterotomia lateral fechada tornou-se a
opção mais aceita no tratamento cirúrgico das fissuras
anais, resultando em cicatrização rápida e menor efeito
deletério sobre o controle esfincteriano
1, 36 . Além disso, pode ser realizada em unidade de cirurgia ambulatorial
49 e evita uma ferida intra-anal aberta, mantendo a ponte de
pele sobre o ponto de divisão muscular, com redução da
dor, desconforto e de secreção local
12, 17, 22, 30 . Por esses motivos, a técnica de esfincterotomia lateral subcutânea
fechada é considerada o tratamento padrão pela Sociedade
Americana de Cirurgiões Colo-Retais
43 .
Em relação à extensão da esfincterotomia, advogava-se
a divisão de quase toda a extensão do EIA desde a
descrição pioneira de Eisenhammer
8 em 1951, embora na prática
clínica recomende-se a divisão parcial de apenas um terço à
metade de sua extensão distal abaixo da linha pectínea,
que corresponde aproximadamente a 1 a 2 cm 1, 15, 17, 36,
39 . De outra forma, propõe-se a execução de esfincterotomia
lateral, parcial, em extensão similar à fissura anal, o que
corresponde no máximo a 50-60% da extensão muscular
37, 42 .
Em mulheres, a presença de canal anal mais curto e
a possibilidade de trauma obstétrico prévio (com lesões
ocultas do EEA) aumentam o risco de incontinência
pós esfincterotomia. Por esses motivos, outras opções
podem eventualmente ser consideradas, como uma divisão
muscular mais limitada ou mesmo o tratamento não
cirúrgico da fissura anal 50 .
Dentro deste contexto, nos dias atuais, o
tratamento das fissuras anais reflete uma maior compreensão da
função do EIA, seu papel na patogênese desta condição e
as conseqüências de sua secção inadequada.
Uma opção técnica mais raramente utilizada é a
confecção de "flaps" anais. Estes foram utilizados para
cobrir defeitos na área perianal e do canal anal com retalhos
de pele sadia, para tratar ectrópio da mucosa anal e mais
recentemente para recobrir áreas de fissuras crônicas e
recorrentes 45 . Suas aplicações potenciais devem se
restringir, atualmente, a pacientes com risco de incontinência
fecal pós-esfincterotomia, como em idosos, mulheres
multíparas ou pacientes com comprometimento prévio do
nervo pudendo 23 . Fissuras com estenose anal por perda de
substância constituem outra indicação.
Estudos recentes pavimentaram o caminho para uma
nova opção terapêutica que é a a "esfincterotomia química"
obtida pela aplicação local de doadores de óxido nítrico
(nitroglicerina, trinitrato de glicerina). O óxido nítrico é
reconhecido como o principal neuro-transmissor inibitório no EIA
A uso tópico de "doadores de óxido nítrico" como
mensageiros químicos para promover o relaxamento do EIA
18 e melhorar o fluxo sangüíneo da anoderme
2 tem obtido resultados controversos. Este efeito duplo tem
propiciado a cicatrização de fissuras anais em 47 a 83% dos
pacientes após 6 a 8 semanas de aplicação local de pastas
2, 11, 14, 47 , mas pode ter efeitos colaterais como dor de cabeça
em 70% dos pacientes e recidiva em 30% 2,
27 . Da mesma forma, o uso de toxina botulínica tem obtido
resultados apenas parciais 7 .
Por esses motivos, essas alternativas terapêuticas
podem ser indicadas a pacientes de risco quanto à
ocorrência de complicações advindas da esfincterotomia cirúrgica
(cirurgia esfincteriana prévia, recusa de cirurgia, etc).
Talvez a realização de eletromanometria possa trazer
informações complementares ao exame físico e à história clínica a
fim de diferenciar pacientes que possam se beneficiar de
procedimentos não cirúrgicos que preservem a
integridade esfincteriana.
Summary: The authors review some aspects related to the pathogenesis and surgical treatment of anal fissures, with emphasis to the results regarding post-operative healing and continence. Anal fissure is a common proctologic disease which etiology is still not completely understood, and it is associated with elevated basal pressures of the internal anal sphincter (IAS), anal trauma and reduced perfusion at the posterior anoderm. Surgical sphincterotomy aims to reduce internal anal pressure and prevent reflex contraction after the passage of stools. Historically, lateral sphincterotomy succeeded the posterior one (to reduce post-operative soiling) and the closed technique succeeded the open one (to reduce pain). Although internal sphincterotomy leads to successful healing of the fissure in more than 95% of patients, there are reports of early and temporary minor fecal incontinence after surgery. Fortunately, permanent or severe deficiency occurs in less than 1% of patients. Thus, patients with high risk of developing continence problems may be treated with topical pastes containing nitric oxide or surgical procedures like anal advancement flaps. The association of manometric studies may complement physical examination data in order to select which patients may benefit from these forms of treatment.
Key words: anal fissure, sphincterotomy, anal incontinence.
Referências Bibliográficas
1. Abcarian H. Surgical correction of chronic anal fissure: results of
lateral anal sphincterotomy vs. fissurectomy-midline sphincterotomy. Dis
Colon Rectum 1980; 23: 31 6.
2. Altomare DF, Rinaldi M, Milito G, Arcanà F, Spinelli F, Nardelli N,
Scardigno D, Pulvirenti A, Bottini C, Pescatori M, Lovreglio R. Glyceril trinitrate
for chronic anal fissure healing or headache ? Dis Colon Rectum 2000;
43: 174 181.
3. Bacon HE, Ross ST, Recio PM. Proctology. Philadelphia: JB
Lippincott 1956: 68.
4. Bennett RC; Goligher JC. Results of internal sphincterotomy for
anal fissure. BMJ 1962; 2: 1500 3.
5. Blaisdell PC. Pathogenesis of anal fissure and implications as to
treatment. Surg Gynecol Obstet 1937; 65: 672 7.
6. Boulos PB, Araujo JG. Adequate internal sphincterotomy for chronic
anal fissure: subcutaneous or open technique. Br J Surg 1984; 71: 360 2.
7. Brisinda G, Maria G, Bentivoglio AR, Cassetta E, Gui D, Albanase A.
A comparison of injections of botulinum toxin and topical
nitroglycerine ointment for the treatment of chronic anal fissure. N Engl J Med 1999;
341: 65-9.
8. Eisenhammer S. The surgical correction of chronic anal
(sphincteric) contracture. S Afr Med J 1951; 25: 486 9.
9. Eisenhammer S. The internal anal sphincter: its surgical importance. S
Afr Med J 1953; 27: 266.
10. Eisenhammer S. The evaluation of internal anal sphincterotomy
operation with special reference to anal fissure. Surg Gynecol Obstet 1959; 109:
583 - 90.
11. Evans J, Luck A, Hewett P Glyceryl trinitrate vs. lateral
sphincterotomy for chronic anal fissure. Prospective, randomized trial. Dis Colon
Rectum 44: 93 97, 2001.
12. Fraiha A, Habr-Gama A, Verani E, Goffi FS. Esfincterotomia lateral
no tratamento da fissura anal. Técnica e resultados. Rev Hosp Clin Fac
Med S Paulo 1975; 30: 161 4.
13. Gibbons CP; Read NW. Anal hypertonia in fissures: cause or effect? Br
J Surg 1986; 73: 443-5.
14. Gorfine SR. Treatment of benign anal disease with topical
nitroglycerin. Dis Colon Rectum 1995; 38: 453 7.
15. Habr-Gama A Cirurgia ano-retal. Técnicas. In: Goffi FS (Ed.)
Técnica Cirúrgica. Bases anatômicas, fisiopatológicas e técnicas da cirurgia.
Rio de Janeiro, Atheneu, pp 792 805, 1978.
16. Hancock BD. The internal sphincternand anal fissure. Br J Surg 64:
92, 1977.
17. Hawley PR. The treatment of chronic fissure-in-ano: a trial of methods.
Br J Surg 1969; 915 8.
18. Hechtman HB, Barlow C. Moderation of anal sphincter tone with
nitric oxide agonists and antagonists. Arch Surg 1996; 131: 775 8.
19. Hoffman DC; Goligher JC. Lateral subcutaneous internal
sphincterotomy in treatment of anal fissure. BMJ 1970: 3: 673 5.
20. Khubchandani IT, Reef JF. Sequelae of internal sphincterotomy for
chronic fissure in ano. Br J Surg 1989; 76: 431 4.
21. Klosrhalfen B, Vogel P, Rixen H, Mittermayer C. Topografy of the
inferior rectal artery: a possible cause of chronic, primary anal fissure. Dis
Colon Rectum 1989; 32: 43 52.
22. Kortbeek JB, Langevin JM, Khoo RE, Heine JÁ. Chronic fissure-in-ano:
a randomized study comparing open and subcutaneous lateral
internal sphincterotomy. Dis Colon Rectum 1992; 35: 832 5.
23. Leong AF, Seow-Choen F. Lateral sphincterotomy compared with
anal advancement flap for chronic anal fissure. Dis Colon Rectum 1995; 38: 69 71.
24. Lewis TH, Corman MI, Prager ED, Robertson WG. Long-term results
of open and closed sphincterotomy for anal fissure. Dis Colon Rectum
1988; 31: 368 71.
25. Lock MP; Thompson JPS. Fissure-in-ano: the initial management
and prognosis. Brit J Surg 1977; 64: 355 8.
26. Lockhart Mummery JP. Disease of the rectum and anus. New York,
William Wood, 1914; 169 171.
27. Lund JN, Scholefield JH. A randomised, prospective, double-blind,
placebo-controlled trial of glyceryl trinitrate ointment in treatment of anal
fissure. Lancet 1997; 349: 11-14.
28. Mazier WP. Keyhole deformity: fact and fiction. Dis Colon Rectum 28:
8, 1985.
29. Morgan CN, Thompson HR. Surgical anatomy of the anal canal
with special reference to the surgical importance of the internal sphincter
and conjoint longitudinal muscles. Ann Royal Coll Surg 1956; 19: 88.
30. Nahas P, Nahas SC, Sobrado Jr CW. Fissura anal. In: Tratado de
Clínica Cirúrgica, Ed Atheneu, São Paulo, p. 1113 - 1117, 1994.
31. Nahas SC, Sobrado Jr CW, Araujo SEA, Aisaka AA, Habr-Gama A,
Pinotti HW. Fissura anal crônica: resultados do tratamento cirúrgico em 220
doentes. Rev Hosp Clin Fac Med S Paulo 1997; 52: 246 49.
32. Nelson RL. Meta-analysis of operative techniques for fissure-in-ano.
Dis Colon Rectum 1999; 42: 1424 1431.
33. Notaras MJ. Annual report, St Mark's Hospital. London, 1966.
34. Notaras MJ. Lateral subcutaneous sphincterotomy for anal fissure: a
new techinique. J R Soc Med 1969: 62: 713.
35. Notaras MJ. The treatment of anal fissure by lateral
subcutaneous sphincterotomy: a techinique and results. Br J Surg 1971: 58: 96.
36. Notaras MJ. Anal fissure and stenosis. Surg Clin North Am 1988;
68:1427-40.
37. Nyam DC; Pemberton JH. Long-term results of lateral
internal sphincterotomy for chronic anal fissure with particular reference
to incidence of fecal incontinence. Dis Colon Rectum 1999; 42: 1306 10.
38. Oh C, Divino CM, Steinhagen RM Ana Fissure. 20-year experience.
Dis Colon Rectum 38: 378 82, 1995.
39. Parks AG. The management of fissure-in-ano. Hosp Med 1967; 1: 737 43.
40. Regadas FSP, Habr-Gama A, Nahas P, Nicodemo AM.
Estudo eletromanométrico da região anorretal em portadores de fissura anal
crônica inespecífica antes e após a esfincterotomia lateral interna. Rev
Bras Colo-Proct 1990; 10: 126 33.
41. Récamier JCA. Extension, massage et percussion cadencee dans
le traitment des contratures musculaires. Rev Med Fr 1838; 1: 74 89.
42. Richard C, Gregoire R, Plewes A, Sivreman R, Burul C, Buie D, Reznick
R, Ross T, O'Connor B, McLeod R. A randomised controlled trial
(RCT) comparing topical nitroglycerine (NTG) and internal sphincterotomy
(IS) in the treatment of chronic anal fissure (CAF). Dis Colon Rectum 1999;
42: A13.
43. Rosen L, Abel ME, Gordon PH, Denstman FJ, Fleshman JW, Hicks
TC, Huber PJ, Kennedy HL, Levin SE, Nicholson JD, et al. Practice
parameters for the management of anal fissure. The Standards Task Force
American Society of Colon and Rectal Surgeons. Dis Colon Rectum 1992; 35 (2)
: 206-208.
44. Saclarides TJ; Brand MI. Evolving trends in the treatment of
anorectal diseases. Dis Colon Rectum 1999; 42: 1245 52.
45. Samson RB, Stewart WR. Sliding skin grafts in the treatment of
anal fissures. Dis Colon Rectum 1970; 13: 372 5.
46. Sangwan YP, Schoetz DJ, Murray JJ, Roberts PL, Coller JÁ.
Perianal Crohn's disease. Results of a local surgical treatment. Dis Colon
Rectum 1996; 39: 529 35.
47. Schouten WR, Briel JW, Auwerda JJ, deGraaf EJ. Relationship
between anal pressure and anodermal blood flow. The vascular pathogenesis
of anal fissures. Dis Colon Rectum 1994; 37: 664 9.
48. Schouten WR, Briel JW, Auwerda JJ, deGraaf EJ. Ischaemic nature of
anal fissure. Br J Surg 1996; 83: 63 5.
49. Sobrado CW; Sokol S. Esfincterotomia interna lateral subcutânea
em unidade ambulatorial para o tratamento da fissura anal. Análise de
265 doentes. Rev Bras Colo-Proct 1994; 14: 235 39.
50. Sultan AH, Kamm MA, Nichols RJ, Bartram CI. Prospective study f
the extent of internal anal sphincter division during lateral
sphincterotomy. Dis Colon Rectum 1994; 37: 1031 1033.
51. Williams N, Scott NA, Irving MH. Effect of lateral sphincterotomy
on internal anal sphincter function. A computerized vector manometry
study. Dis Colon Rectum 1995; 38: 700 704.
Endereço para Correspondência:
Rua Padre João Manuel, 222 Cj 120 - Cerqueira César
São Paulo
CEP: 01411-000
Fone/Fax: (011) 3064.7010
e-mail: fgcampos@osite.com.br
Trabalho realizado na Disciplina de Colo-Proctologia do Departamento de Gastroenterologia do Hospital das Clínicas da Faculdade de Medicina da USP