|
|
|
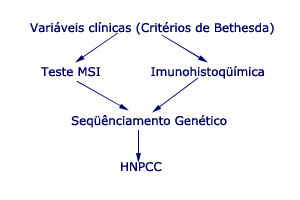
Figura 1 - Protocolo de investigação de famílias suspeitas de HNPCC. |
ARTIGOS ORIGINAIS
RAUL CUTAIT-TSBCP
GUILHERME COTTI
BERNARDO GARICOCHEA
CLÁUDIA MURARO
FÁBIA CARVALHO -TSBCP
KATIA LEITE
LUIZ H. CAMARA-LOPES
CUTAIT R,COTTI G, GARICOCHEA B, MURARO C, CARVALHO F, LEITE K, CAMARA-LOPES LH.
Instabilidade de microssatélites em portadores de câncer colo-retal.
Rev bras coloproct, 2002(4):225-232
Resumo: Embora considerado uma das mais importantes síndromes de predisposição ao câncer, o câncer colo-retal hereditário não-polipose (HNPCC) permanece um desafio na prática clínica diária. Os critérios de Amsterdam (CA), embora altamente específicos, têm valor muito limitado, inclusive para nossa população, pois são extremamente restritivos. Assim, foram propostos os critérios de Bethesda, menos restritivos, com o intuito de levantar a suspeita de HNPCC e a utilização de testes laboratoriais, como a instabilidade de microssatélites, para auxiliar a definir um maior número de famílias de risco para HNPCC. Objetivo: Avaliar o impacto dos CB no rastreamento de famílias de risco para HNPCC através do teste de instabilidade de microssatélites (MSI).Materiais e métodos: 47 pacientes portadores de câncer colo-retal que preenchiam pelo menos um dos CB e cuja história familiar pôde ser coletada, foram submetidos ao teste de MSI. Resultados: MSI-H foi identificada em 16 (34%) dos pacientes e se correlacionou com: idade precoce de aparecimetno do tumor (47,6 vs 58,9 anos no grupo não MSI-H; p=0,012), com os critérios de Amsterdam (p=0,001), com a história de câncer colo-retal ou endometrial em um parente com idade inferior a 45 anos (p=0,004) e com a presença de 2 ou mais CB em um mesmo indivíduo (p<0,001). Conclusões: Estas variáveis são capazes de identificar famílias de alto risco para HNPCC, as quais devem ser submetidas à aconselhamento genético e análise mutacional dos genes de reparo do DNA.
Unitermos: Câncer colo-retal hereditário, HNPCC, instabilidade de microssatélites
INTRODUÇÃO
Nos últimos anos, tornou-se cada vez mais evidente
a real interferência genética na origem do câncer
colo-retal hereditário
(CCRH)1,2,3. Embora constituam pequena parcela no total de casos de câncer
colo-retal (CCR), tanto a polipose adenomatosa familiar
(PAF) quanto o câncer colo-retal hereditário
não-polipoide (HNPCC), as duas principais vertentes e
representantes do CCRH, são focos de intensa pesquisa na área
da biologia molecular. Atualmente reconhecem-se
duas vias na patogênese molecular do CCR: uma
via clássica, decorrente de instabilidade
cromossômica, que surge através da inativação do gene supressor
de tumor APC, cuja transmissão mendeliana de um
alelo mutado constitui a alteração genética característica
da PAF; e uma segunda via, decorrente da
instabilidade de microssatélites (MSI), fruto da inativação
das proteínas de reparo do DNA, base molecular
do HNPCC.
HNPCC é uma doença autossômica
dominante a qual se associa a cerca de 5% do total de casos
de CCR 4. É causada pela inativação de um dos seis
genes relacionados com o reparo do DNA durante
sua replicação, conhecidos como genes de reparo
de pareamento do DNA (mismatch repair). Dois genes estão especialmente implicados nesta síndrome,
o MSH2 e o MLH1, uma vez que mutações nestes
genes constituem cerca de 90% das alterações
genéticas descritas até o
presente5. Os portadores de mutações
nos genes de reparo desenvolvem câncer colo-retal
numa idade precoce, em média aos 45 anos de idade,
sendo que os tumores comumente têm localização proximal
à flexura esplênica e os indivíduos afetados
apresentam tendência para a ocorrência de lesões sincrônicas
e metacrônicas6. Além disso, membros de
algumas famílias têm risco elevado para inúmeras
outras neoplasias, tais como de endométrio, intestino
delgado, estômago, urotélio e pelve renal e ovário, entre
outras7,8.
O diagnóstico de HNPCC pode ser
realizado de duas maneiras: clinicamente, através
do preenchimento dos critérios de Amsterdam
propostos pelo ICG-HNPCC (International Collaborative
Group on HNPCC) (Tabela-1)9-11; e geneticamente,
pela identificação de mutações, através de
sequenciamento do DNA de genes de reparo mencionados
anteriormente. Embora isso pareça simples, na prática
os médicos encontram enormes dificuldades
para estabelecer tal diagnóstico, seja porque não
dispõem de informações familiares adequadas com relação
ao histórico do paciente, seja porque o
seqüenciamento genético não é ainda uma realidade na prática
médica. Como estes entraves se repetem em diversos
países, inclusive no nosso, protocolos de rastreamento
de famílias em risco para HNPCC foram propostos,
sendo o mais aceito atualmente o descrito na Figura-1.
Assim, o médico pode selecionar famílias através dos
critérios de Bethesda, que são menos restritivos que os
de Amsterdam (Tabela-2)12. A tendência atual é iniciar
a investigação genética das famílias suspeitas com
a execução do teste de instabilidade de
microssatélites (MSI) e/ou a imunohistoquímica para proteínas
dos genes de reparo do DNA, por serem exames menos onerosos e mais exequíveis que o sequenciamento.
Uma vez que um destes testes laboratoriais
mostra-se alterado, passa a existir a indicação formal para
a pesquisa de mutações por sequenciamento nos
genes de reparo do DNA.
Tabela 1 - Critérios de Amsterdam.
Tabela 2 - Critérios de Bethesda.
Corforme comentado, a MSI representa uma característica fenotípica marcante do HNPCC,
estando presente em 80% a 90% dos tumores nesta
síndrome13,14. Todavia, chega a ocorrer em até 15%
dos cânceres colo-retais ditos
esporádicos13,14, sendo que a hipermetilação do promotor do gene MLH1
parece corresponder à principal alteração genética
responsável por esta alteração nos tumores esporádicos.
Figura 1 - Protocolo de investigação de famílias suspeitas
de HNPCC.
O objetivo deste estudo foi verificar a ocorrência de instabilidade de microssatélites numa população de pacientes portadores de câncer colo-retal que preenchiam pelo menos um dos critérios de Bethesda e avaliar a utilização dos mesmos no rastreamento de famílias em risco para HNPCC.
PACIENTES E MÉTODOS
Pacientes
Foram incluídos neste estudo 47
pacientes operados por adenocarcinoma colo-retal no
Hospital Sírio-Libanês, entre 1992 e 2000, que preenchiam
pelo menos um dos critérios de Bethesda, e cuja
história familiar de neoplasias pôde ser coletada.
Constituiram-se em critérios de exclusão do presente estudo:
(1) radioterapia ou quimioterapia prévias; (2)
polipose adenomatosa familiar e correlatas; (3)
doença inflamatória intestinal associada; e (4) tumores de
canal anal.
A idade dos pacientes na época do
diagnóstico variou de 26 a 85 anos, com média de 55 anos
e mediana de 53 anos. Quanto ao sexo, 26 (55,3%) pacientes eram do sexo masculino e 21 (44,7%)
do sexo feminino.
Teste de MSI
Os pacientes que se enquadravam nestas características tiveram seus tumores submetidos
ao teste de instabilidade de microssatélites
(MSI), conforme a técnica de Peltomäki et al.
(1993a)15, num painel composto por oito loci, correspondentes
a repetições de mononucleotídeos e
dinucleotídeos, mapeados para seis diferentes cromossomos. Os
cinco primeiros marcadores (BAT25, BAT26, D5S346, D2S123, D17S250) compõem o painel básico
sugerido para avaliação do teste MSI nos pacientes
elegíveis 13,14,16. Além disto, pelo fato da importância
de determinados marcadores poder variar em
diferentes amostras populacionais, e por não haver estudos
sobre a relevância de tais marcadores na população
brasileira, neste estudo optou-se por também utilizar outros
três marcadores (BAT40, TP53.PCR15.1,
D11S904), buscando-se ampliar a análise dos casos avaliados.
O DNA dos espécimes cirúrgicos
preservados em parafina foi extraído pelo método do
xilol-etanol, de acordo com o protocolo de WRIGHT DK &
MANOS MM PCR PROTOCOLS (1990)17.
As amplificações foram realizadas
pelo processo de reação em cadeia da polimerase
(PCR). Utilizando-se 100ng de DNA purificado em um
volume final de 25µl, em um termociclador (MJ
Research Thermocycler - PTC 100; MJ Research,
Watertown, MA / ou / Perkin ELMER Gene Amp PCR
System 2400). Subseqüentemente, os produtos do PCR
foram analisados por eletroforese em um gel de
poliacrilamida a 10%/gel uréia 7 M (16 horas, 450V,
temperatura ambiente) em uma cuba seqüenciadora
(Life Technologies Model S2 Sequencing Gel Electrophoresis) e coloração com nitrato de prata
0,1%, como descrito previamente18.
A instabilidade de microssatélites foi
definida quando, após a amplificação do DNA tumoral
pelo PCR, ocorreu surgimento ou desaparecimento de bandas em comparação com os produtos de PCR
de um DNA normal correspondente (Figura-2). Cada
locus foi analisado por observador independente e
recebeu os seguintes escores: alta instabilidade (MSI-H)
- presença de instabilidade de microssatélites em
30% ou mais dos marcadores; baixa instabilidade
(MSI-L) presença de instabilidade de microssatélites em
menos de 30% dos marcadores; estável (MSS) - presença
de estabilidade de microssatélites.
|
|
|
Figura 2 - Gel de leitura do teste de MSI: observar a ausência de instabilidade para o locus BAT40 - todas as bandas entre o tecido tumoral (TU) e normal (NL) são congruentes; e a presença de uma banda extra no tecido tumoral do locus BAT26, caracterizando a presença de instabilidade nesta região. |
RESULTADOS
Dos 47 pacients, 16 (34%) apresentaram instabilidade de microssatélites alta
(MSI-H), caracterizando o fenótipo de erro de replicação
(RER+), enquanto que, dos 31 pacientes que não
apresentaram erro de replicação (RER-), 8 (17%)
mostraram instabilidade de microssatélites baixa (MSI-L) e
23 (49%) estabilidade de microssatélites estável
(Tabela-3). A média de idade dos pacientes RER+ foi de
47,6 anos (mediana 44) e a dos RER- de 58,9 anos
(mediana 59) (p=0,012) (Tabela-4). Dividindo os pacientes
de acordo com a idade, 9 dos 15 (60%) daqueles com
idade menor ou igual a 45 anos eram RER+, ao passo que
7 dos 32 (21,9%) acima dos 45 anos eram RER+ (p=0,01).
Tabela 3 - Resultados do teste de instabilidade de microssatélites.
| MSI | N | % |
| alta | 16 | 34 |
| baixa | 8 | 17 |
| estável | 23 | 49 |
| Total | 47 | 100 |
| Fenótipo RER | MSI | N* | % | Idade média |
| RER+ | alta | 16 | 34 | 47,6 |
| RER- | baixa/estável | 31 | 66 | 58,9 |
| Total | 47 | 100 | ||
| * p=0,012 | ||||
Quanto à presença de história familiar de
câncer colo-retal, 9 dos 16 pacientes com essa
característica eram RER+, e 7 dos 31 pacientes sem casos de
câncer colo-retal na família foram RER + (p=0,02).
Com relação aos critérios de Bethesda, 32
dos 47 (68%) pacientes estudados preencheram apenas
um critério; e 15 (32%) pacientes atendiam 2 ou
mais critérios. Além nisso, verificou-se que 13 dos 15
(86,7%) pacientes que preencheram mais de um
critério de Bethesda apresentaram fenótipo RER
positivo; versus 3 em 32 (9,4%) pacientes no grupo com
somente um critério (p<0,001) (Tabela-5).
Tabela 5 - Comparação dos resultados.
| RER + | RER - | p | ||
| Critérios de Amsterdam | presente | 8 | 0 | 0,001 |
| ausente | 8 | 3 | 1 | |
| Idade < 45 anos | 9 | 6 | 0,01 | |
| > 45 anos | 7 | 25 | ||
| História familiar de qualquer câncer | presente | 12 | 21 | NS |
| ausente | 4 | 10 | ||
| História familiar com câncer extra-cólico relacionado com HNPCC | presente | 6 | 10 | NS |
| ausente | 10 | 21 | ||
| História familiar de câncer colo-retal | presente | 9 | 7 | 0,02 |
| ausente | 7 | 24 | ||
| Nº critérios Bethesda preenchidos | 1 | 3 | 29 | <0,001 |
| > 2 | 13 | 2 | ||
| NS= não significativo | ||||
O fenótipo RER+ esteve
significativamente associado com o 1º critério (p<0,0001) e o 4º critério
de Bethesda (p=0,004). Apresentou tendência à
associação com o 2º critério (p=0,056); e não se associou com
o terceiro, quarto, quinto ou sexto critérios de
Bethesda. Nenhum paciente foi selecionado com base no
sétimo critério, uma vez que o ponto de partida deste
estudo foi a presença de câncer colo-retal (Tabela-6).
Tabela 6 - Relação entre o fenótipo erro de replicação e os critérios de Bethesda.
| Critério de Bethesda | RER + | RER - | P | |
| Critérios Amsterdam | Presente | 8 | 0 | 0,001 |
| Ausente | 8 | 31 | ||
| 2 cânceres relacionados com HNPCC | Presente | 8 | 7 | 0,056 |
| Ausente | 8 | 24 | ||
| CCR + parente 1ºG CCR ou CA extra-Cólico HNPCC e/ou Adenoma colo-retal | Presente | 11 | 15 | NS |
| Ausente | 5 | 16 | ||
| CCR / endometrial abaixo 45 anos | Presente | 9 | 5 | 0,004 |
| Ausente | 7 | 26 | ||
| CA cólon direito Histologia | Presente | 3 | 6 | NS |
| indiferenciado < 45 anos. | Ausente | 13 | 25 | |
| CCR com células em anel de sinete < 45 anos | Presente | 1 | 0 | NS |
| Ausente | 15 | 31 | ||
| (NS= não significativo) | ||||
DISCUSSÃO
A inativação dos genes de reparo
de pareamento do DNA (MMR) constitui a via
genética envolvida na gênese do câncer colo-retal
hereditário não-polipoide
19. Mutações germinativas nos
genes hMLH1 e hMSH2, dois dos principais genes do complexo MMR, estão presentes em 80% a 90%
dos casos de HNPCC 20. O diagnóstico final quanto
à existência de mutação, bem como sua caracterização
é obtido com os testes de seqüenciamento do DNA.
Estes, entretanto, ainda são onerosos, nem sempre
estão disponíveis e apresentam uma sensibilidade ao
redor de 70%, mesmo para pacientes selecionados
21. Isto que dizer que, na atualidade, considerável número
de famílias com HNPCC ainda têm seu
diagnóstico definido pelos critérios de Amsterdam. Contudo,
esses critérios são muito restritivos, pois não levam
em consideração a presença de neoplasias
extra-cólicas associadas a HNPCC, não contemplam
famílias pequenas ou com características genéticas
peculiares e não consideram o efeito fundador. Assim, com
o intuito de identificar famílias com suspeita de
HNPCC foram estabelecidos os já citados e mais
abrangentes critérios de Bethesda e, mais recentemente,
alguns passaram a utilizar associadamente o teste de MSI e
a imunohistoquímica 12,20,21,22,23
Assim, a detecção do fenótipo de erro
de replicação nestes tumores constitui uma
ferramenta importante no rastreamento e identificação
desta síndrome, permitindo que os pacientes que
apresentem teste de MSI positivo, pelo alto grau de suspeita
de HNPCC, sejam candidatos naturais à realização
de pesquisa mutacional nos genes de reparo do DNA
21.
Neste estudo, 34% dos pacientes
apresentaram alta instabilidade de microssatélites (RER+). O
restante dos pacientes foi considerado como não
apresentando erro de replicação, uma vez que tumores com
baixa instabilidade ou estáveis parecem
apresentar características e evolução semelhantes
24,25. A média de idade nos pacientes com teste de instabilidade
de microssatélites positivo foi de 47,6 anos, e de 58,9
anos no grupo RER- (p=0,012). Assumindo o fenótipo
RER+ como um marcador do HNPCC, estes dados aproximam-se das observações da maioria dos
autores, que indicam que o câncer colo-retal no
HNPCC costuma surgir por volta dos 45 anos, enquanto o
câncer colo-retal esporádico manifesta-se em geral a partir
da sexta década de vida 26,27. Outro dado importante
foi que 60% dos pacientes com câncer colo-retal
abaixo dos 45 anos apresentaram fenótipo RER+,
enquanto 21,9% dos pacientes acima dos 45 anos com
câncer colo-retal tiveram fenótipo RER positivo
(p=0,01). Assim, quando o câncer colo-retal estabelece-se
numa idade inferior aos 45 anos, o paciente tem uma
chance muito maior de pertencer a uma família com
uma síndrome de predisposição hereditária ao câncer
27,28, fato atestado pela associação demonstrada entre o
4º critério de Bethesda (câncer colo-retal em
pacientes com idade inferior a 45 anos) e fenótipo
RER+ (p=0,004).
A história familiar de câncer em parentes
de 1º ou 2º grau não apresentou correlação estatística
com o fenótipo de erro de replicação. E, ao contrário
do descrito por vários autores e do que se poderia
imaginar inicialmente, a história familiar de neoplasias
extra-cólicas relacionadas com o HNPCC
29 (endométrio, ovário, estômago, hepatobiliar, intestino
delgado, células de transição da pelve renal ou ureter)
também não esteve estatisticamente associada ao
fenótipo RER+. Apenas a história familiar de câncer
colo-retal apresentou correlação com o fenótipo RER+.
Nas 8 famílias de pacientes que
preencheram os critérios de Amsterdam, os probandos
foram classificados como RER+ (p<0,001).
Conforme observação de Dieumegard
30, o fenótipo RER+ ocorreu em 90% das famílias que preencheram os critérios
de Amsterdam, e quanto mais relevante a história
familiar de neoplasias cólicas, maior a chance do paciente
ser portador de HNPCC. Desta forma, apesar das limitações enumeradas, os critérios de
Amsterdam permanecem de grande valia, de modo que a
coleta adequada da história familiar dos pacientes é
um instrumento simples, que permite a obtenção
de informações extremamente relevantes, e jamais
deve ser negligenciada ou pouco valorizada pelo
médico28.
Excetuando-se o primeiro critério de
Bethesda, o critério de maior correlação com o fenótipo
RER+ foi o da idade de instalação do tumor (pacientes
com idade inferior aos 45 anos). Quanto à história
pessoal de câncer do paciente extra-cólico, relacionados
com HNPCC, ou tumores cólicos sincrônicos
e metacrônicos (segundo critério de Bethesda) com
o fenótipo RER+, já descrito por muitos autores
6,21, houve uma tendência à correlação estatística
(p=0,056). Além disto, não foi verificada significância
estatística entre a instabilidade alta de microssatélites e
demais critérios de Bethesda avaliados.
Por fim, a observação mais importante
deste estudo diz respeito ao número de critérios de
Bethesda preenchidos por cada paciente: 13 dos 15
pacientes (86,7%) que preencheram mais de um critério
de Bethesda apresentaram fenótipo RER+; versus 3
em 32 dos pacientes (9,4%) no grupo que atendia
apenas um deles (p<0,001). Logo, o número de
critérios preenchidos por um paciente se associa a um
maior risco deste se enquadrar no espectro de HNPCC,
sendo que os critérios mais relevantes segundo este
estudo foram os critérios de Amsterdam e a idade de
câncer colo-retal diagnosticado abaixo dos 45 anos, além
de possivelmente o segundo critério.
Na busca da diferenciação dos casos
de HNPCC daqueles de câncer colo-retal esporádico,
os resultados deste estudo atestaram a importância
da idade de aparecimento, da presença de história
familiar e, principalmente, os critérios de Bethesda.
Estes, aliados ao teste de instabilidade de
microssatélites, poderão permitir a identificação de uma população
de risco para HNPCC, que deve ser submetida a aconselhamento genético, programas específicos
de rastreamento e encaminhada para análise
mutacional no complexo MMR.
CONCLUSÕES
O fenótipo RER+ associou-se com CCR
em famílias que preencheram os critérios de
Amsterdam, em indivíduos jovens e na presença de dois ou
mais critérios de Bethesda num mesmo
indivíduo. Considerando-se o custo do teste de MSI, o acesso
ainda restrito ao exame e a escassez de recursos, do ponto
de vista de saúde pública pode-se priorizar o teste
para pacientes com CCR abaixo dos 45 anos e
naqueles pacientes que atendem a mais de um critério de Bethesda.
Agradecimentos
A FAPESP _ Fundação de Amparo à Pesquisa do
Estado de São Paulo _ que apoiou a realização deste projeto
através de bolsa de iniciação científica concedida
no período de graduação do autor Guilherme Cotti.
Summary: Introduction: Besides being one of the most important syndromes of cancer predisposition, the diagnosis of hereditary non-polyposis colorectal cancer (HNPCC) remains a challenge in clinical practice. The Amsterdam criteria are highly sensitive but restrictive. In order to lessen this problem, the Bethesda criteria (BC) were proposed to enhance the possibility of diagnosis in suspected families and are being used in combination with laboratory tests (microsatellite instability and imunohistoquemistry) to screen for HNPCC families. Objective: To evaluate the use of BC to screen for HNPCC families with microssatellite insbtability. Materials and Methods: 47 colorectal cancer patients that attended at least one BC and whose family history could be obtained were submitted to MSI analysis. Results: MSI-H was identified in 16 (34%) patients and was significantly correlated with lower age (47.6 vs 58.9 in non-MSI-H group; p=0.012), with the Amsterdam criteria (p=0.001), with the history of colorectal or endometrial cancer in one first degree relative under 45 (p=0.004) and with the combination of 2 BC in a single individual (p<0.001). Conclusion: These variables are able to identify high risk families for HNPCC that should have further genetic counseling and DNA analysis.
Key words: Hereditary colorectal cancer, HNPCC, microsatellite instability
REFERÊNCIAS BIBLIOGRÁFICAS
1. Waliszewski P - Colorectal carcinoma as a
genetic phenomenon. Patol Pol 1992; 43(3): 73-78.
2. Lynch HT, Lanspa SJ, Boman BM, Smyrk TC, Watson P,
Lynch JF, Lynch PM, Cristofaro G, Bufo P, Tauro AV -
Hereditary nonpolyposis colorectal cancer, Lynch syndromes 1 and 2.
Gastroenterol Clin North Am 1988; 17(4): 679-712.
3. Groden J, Thliveris A, Samowitz W, Carlson M, Gelbert
L, Albertsen H, Joslyn G, Stevens J, Spirio L Robertson M
- Identification and characterization of the familial
adenomatous poliposis coli gene. Cell 1991; 66(3): 589-600.
4. Aaltonen LA, Salovaara R, Kristo P, Canzian F,
Hemminki A, Peltomaki P, Chadwick RB, Kaariainen H, Eskelinen
M, Jarvinen H, Mecklin JP, De La Chapelle A - Incidence
of hereditary nonpolyposis colorectal cancer and the
feasibility of molecular screening for the disease.
N Engl J Med 1998 May 21;338(21):1481-1487.
5. Peltomaki P, Vasen HF - Mutations predisposing to
hereditary nonpolyposis colorectal cancer: database and results of
a collaborative study. The International Collaborative Group
on Hereditary Nonpolyposis Colorectal Cancer.
Gastroenterology 1997 Oct;113(4):1146-1158.
6. Fitzgibbons RJ Jr, Lynch HT, Stanislav GV, Watson
PA, Lanspa SJ, Marcus JN, Smyrk T, Kriegler MD, Lynch JF
- Recognition and treatment of patients with
hereditary nonpolyposis colon cancer (Lynch syndromes I and
II). Arch Surg 1987; 206: 289-295.
7. Vasen HF, Wijnen JT, Menko FH, Kleibeuker JH, Taal
BG, Griffioen G, Nagengast FM, Meijers-Heijboer EH,
Bertario L, Varesco L, Bisgaard ML, Mohr J, Fodde R, Khan PM
- Cancer risk in families with hereditary nonpolyposis
colorectal cancer diagnosed by mutation analysis.
Gastroenterology 1996 Apr;110(4):1020-1027.
8. Aarnio M, Sankila R, Pukkala E, Salovaara R, Aaltonen
La, De La Chapelle A, Peltomaki P, Mecklin JP, Jarvinen HJ
- Cancer risk in mutation carriers of
DNA-mismatch-repair genes. Int J Cancer 1999 Apr 12;81(2):214-218.
9. Thorson AG, Knezetic JA, Lynch HT - A century of
progress in hereditary nonpolyposis colorectal cancer (Lynch
syndrome). Dis Colon Rectum 1999 Jan;42(1):1-9.
10. Lynch HT, Smyrk T, Lynch JF - Overview of natural
history, pathology, molecular genetics and management of
HNPCC (Lynch Syndrome). Int J Cancer 1996 Feb 20;69(1):38-43.
11. Vasen HF, Watson P, Mecklin JP, Lynch HT - New
clinical criteria for hereditary nonpolyposis colorectal
cancer (HNPCC, Lynch syndrome) proposed by the International
Collaborative Group on HNPCC.
Gastroenterology 1999 Jun;116(6):1453-1456.
12. Rodriguez-Bigas MA, Boland CR, Hamilton SR, Henson
DE, Jass JR, Khan PM, Lynch H, Perucho M, Smyrk T, Sobin
L, Srivastava S - A National Cancer Institute Workshop on
Hereditary Nonpolyposis Colorectal Cancer Syndrome:
meeting highlights and Bethesda guidelines. J Natl Cancer
Inst 1997; 89(23):1758-62.
13. Boland CR, Thibodeau SN, Hamilton SR, Sidransky
D, Eshleman JR, Burt RW, Meltzer SJ, Rodriguez-Bigas
MA, Fodde R, Ranzani GNm, Srivastava S - A National
Cancer Institute Workshop on Microsatellite Instability for cancer
detection and familial predisposition: development of
international criteria for the determination of microsatellite
instability in colorectal cancer. Cancer
Res 1998 Nov 15; 58(22):5248-5257.
14. Dietmaier W, Wallinger S, Bocker T, Kullmann F, Fishel
R, Ruschoff J - Diagnostic microsatellite instability:
definition and correlation with mismatch repair expression.
Cancer Res 1997; 57:4749-4756.
15. Peltomäki P - Microsatellite instability is associated with
tumors that characterize the hereditary non-polyposis
colorectal carcinoma syndrome. Cancer Res
1993a; 53:5853-5855.
16. Bocker T, Diermann J, Friedl W, Gebert J, Holinski-Feder
E, Karner-Hanush J, Von Knebel-Doeberitz M, Koelble
K, Moeslein G, Schackert HK, Wirtz HC, Fishel R, Ruschoff J
- Microsatellite instability analysis: a multicenter study for
reliability and quality control. Cancer Res 1997; 57:4739-4743.
17. Innis, M - Wright DK & Manos MM PCR Protocols,
Academic Press, 1990. 153 p.
18. Schlegel J, Bocker T, Schlegel J, Bocker T, Zirngibl
H, Hofstadter F, Ruschoff J - Detection of microsatellite
instability in human colorectal carcinomas using a
nonradioactive PCR-based screening technique. Virchows
Arch 1995; 426: 223-227.
19. Powell SM - Clinical applications of molecular genetics
in colorectal cancer. Sem Colon & Rectal
Surg 1995; 6(1): 2-18.
20. Peltomaki P, Vansen HF - Mutations predisposing to
hereditary nonpolyposis colorectal cancer: database and results of
a collaborative study. The International Collaborative Group
on Hereditary Nonpolyposis Colorectal Cancer.
Gastroenterology 1997; 113(4):1146-58.
21. Lynch PM - Clinical challenges in management of
familial adenomatous polyposis and hereditary nonpolyposis
colorectal cancer. Cancer 1999; 86(8 Suppl):1713-9.
22. Vasen HF - Clinical diagnosis and management of
hereditary colorectal cancer syndromes. J Clin
Oncol 2000 Nov 1;18(21 Suppl):81S-92S
23. Terdiman JP, Gum JR Jr, Conrad PG, Miller GA, Weinberg
V, Crawley SC, Levin TR, Reeves C, Schmitt A, Hepburn
M, Sleisenger MH, Kim YS - Efficient detection of
hereditary nonpolyposis colorectal cancer gene carriers by screening
for tumor microsatellite instability before germline genetic
testing. Gastroenterology 2001 Jan;120(1):21-30.
24. Jass JR, Do KA, Simms LA, Iino H, Wynter C, Pillay
SP, Serale J, Radford-Smith G, Young J, Legget B -
Morphology of sporadic colorectal cancer with DNA replication
errors. Gut 1998; 42:673-9.
25. Aaltonen LA, Peltomaki P, Leach FS, Sistonen P,
Pylkkanen L, Mecklin JP, Jarvinen H, Powel SM, Jen J, Hamilton
ST, Petersen GM, Kinzler KW, Volgestein B, De La Chapelle A
- Clues to the pathogenesis of familial colorectal cancer.
Science 1993; 260:812-16.
26. Lin KM, Shashidharan M, Ternent CA, Thorson
AG, Blatchford GJ, Christensen MA, Lanspa SJ, Lemon SJ,
Watson P, Lynch HT - Colorectal and extracolonic cancer
variations in MLH1/MSH2 hereditary nonpolyposis colorectal
cancer kindreds and the general population. Dis Colon Rectum
1998; 41(4):428-33.
27. Peel DJ, Ziogas A, Fox EA, Gildea M, Laham B, Clements
E, Kolodner RD, Anton-Culver H - Characterization of
hereditary nonpolyposis colorectal cancer families from a
population-based series of cases. J Natl Cancer
Inst 2000; 92(18):1517-22.
28. Tinley S, Lynch H - Integration of family history and
medical management of patients with hereditary cancers.
Cancer 1999; 86:1705-12.
29. Watson P, Lynch HT - Extracolonic cancer in
hereditary nonpolyposis colorectal cancer. Cancer
1993; 71(3):677-85.
30. Dieumegard B, Grandjouan S, Sabourin JC, Le Bihan
Ml, Lefrere I, Bellefqih, Pignon JP, Rougier P, Lasser P, Benard
J, Couturier D & Bressac-De Paillerets B - Extensive
molecular screening for hereditary non-polyposis colorectal cancer.
Br J Cancer 2000; 82(4):871-80.
Endereço para correspondência:
Raul Cutait
Rua Adma Jafet, nº 50 - 6º andar
01308-050 - São Paulo - SP
Trabalho realizado no Hospital Sírio e Libanês - São Paulo - SP