
ARTIGOS ORIGINAIS
RELAÇÃO ENTRE A EXPRESSÃO DA MUC1 E OS ESTADIAMENTOS TNM E ASTLER-COLLER NO CÂNCER COLORRETAL
Relation Between the Expression of MUC1 and TNM and Astler-Coller Staging Systems in Colorectal Cancer
PAULA GABRIELA MELO MORAIS1; MANOEL ÁLVARO DE FREITAS LINS NETO2; ANTENOR TEXEIRA LEAL3; CLÁUDIO TORRES DE MIRANDA4; MATEUS DE PAULA ALBUQUERQUE5
1Doutoranda da Faculdade de Medicina da Universidade Federal de Alagoas (FAMED/UFAL), 2Professor Doutor da FAMED/UFAL e Chefe do Serviço de Coloproctologia do Hospital Universitário Prof. Alberto Antunes (HUPAA/UFAL), 3Médico Patologista da Santa Casa de Misericórdia de Maceió, 4Professor Doutor da FAMED/UFAL, 5Residente (R3) do Serviço de Coloproctologia do HUPAA/UFAL.
RESUMO: A expressão de marcadores tumorais que se correlacionam com a agressividade dos cânceres vem sendo investigada com vigor. Tendo o câncer colorretal significativa incidência, biomarcadores que possam avaliá-lo quanto a esse aspecto, não são exceção nesta investigação. OBJETIVO: estabelecer a relação entre agressividade do câncer colorretal de acordo com os estadiamentos TNM e Astler-Coller e a expressão da Mucina1 (MUC1) em uma determinada amostra de tumores. METODOLOGIA: foram examinados 36 cânceres colorretais ressecados pelos coloproctologistas do Hospital Universitário da UFAL quanto à presença de uma reação imuno-histoquímica positiva para MUC1 em padrão citoplasmático. Em seguida, correlacionou-se esta com os estádios dos tumores. RESULTADOS: A imunoexpressão da MUC1 ocorreu em 50% dos casos. Destes, 61% estavam entre os estádios T3 e T4; 39% entre N1 e N2; todos os casos do estudo eram M0; e 40% encontravam-se entre os estádios C1 e C3 de Astler-Coller. Avaliada a positividade por cada estádio em separado, percebeu-se que estes aumentaram proporcionalmente, principalmente em relação aos estadios "N" e Astler-Coller. CONCLUSÃO: a ausência da reatividade imuno-histoquímica à MUC1 não excluiu a possibilidade de evolução para um estadio avançado. Porém, sua presença denota a evolução do câncer colorretal para estádios mais agressivos.
Descritores: Mucinas, Câncer Colorretal, Estadiamento do Câncer, Marcadores de Tumor, Imuno-histoquímica.
INTRODUÇÃO
Os marcadores tumorais, especialmente os moleculares, vêm sendo utilizados extensivamente
com a finalidade de caracterizar os processos
neoplásicos. Quando se emprega os termos marcadores
moleculares ou biomarcadores, refere-se à avaliação de
moléculas específicas nos tecidos quanto à presença de
doença ou indução de alterações em tecidos normais ou
danificados1. Muitos grupos químicos representam
esta categoria, inclusive antígenos, aminoácidos e
ácidos nucléicos, enzimas, poliaminas, além de proteínas
e lipídeos de membrana celular específicas.
Os biomarcadores estão sendo usados recentemente
como indicadores de estágio e grau de diferenciação
tumoral, podendo também ser úteis para monitorar respostas
ao tratamento e prever recidivas1.
Enquanto o sistema de estadiamento tumor-nódulo-metástase (TNM), desenvolvido pelo
American Joint Commitee on Cancer (AJCC) e aprovado
pela International Union Against Cancer
(UICC)2, tem sido comumente usado como o mais confiável preditor
de prognóstico, este novo direcionamento de visão
pode adicionar uma sensibilidade ainda maior a tal
função por usar parâmetros moleculares
adicionais3.
Sabe-se que o epitélio colônico e retal
é recoberto e protegido por muco cuja maioria
das glicoproteínas constituintes são as mucinas
(MUC), proteínas de alto peso molecular ricas em
carboidratos, sendo assim, altamente
glicosiladas3,4,5,6. A mucina I (MUC1), além de ser secretada para constituir o
muco, faz parte também da estrutura das células da
parede do cólon e do reto, expressando alguns de seus
fragmentos na superfície dessas
células3,6,7,8,9. Mucinas ancoradas na membrana podem ter uma função
adicional relacionada com a interação entre proteínas
na superfície celular. Várias alterações podem
ocorrer nestas glicoproteínas transmembrana durante
a carcinogênese colorretal, sendo algumas
responsáveis por implicações
fisiopatológicas5,8. Mudanças na
estrutura e distribuição das mucinas na célula
epitelial são estimadas serem causas de malignização e
progressão do tumor ao alterar o comportamento
biológico das células
cancerígenas5,10. Além disso,
algumas mucinas vêm sendo associadas à
imunossupressão tumoral11.
As alterações estruturais e quantitativas
ocorridas nestas moléculas se dão em nível de
epítopos, que podem eventualmente ser considerados
antígenos, sendo identificados por técnicas de
imuno-histoquímica nas células de cânceres colorretais por induzirem
resposta antígeno-específica quando se mostram
fortemente expressos na estrutura celular de tais
tumores, mostrando-se negativos em mucosa colorretal
normal8,9,12. Tal resposta imune pode também induzir
a produção de anticorpos que podem ser detectados
na circulação sendo úteis no diagnóstico precoce e
análise imunológica da
neoplasia13. Todavia, devido ao metabolismo bacteriano, não é possível encontrar
a MUC1 em amostras de fezes, apesar destas estarem presentes no lúmen colônico assim como
a glicoproteína8.
Os adenocarcinomas de cólon e reto,
especificamente, têm sido definidos como tumores
compostos por mucina em 50% ou mais dos casos relatados
em estudos1. Quando se relaciona a expressão da
MUC1 e o estadiamento do câncer, essa glicoproteína é
mais freqüentemente expressa em carcinomas de alto
grau de estadiamento do que em câncer colorretal de
baixo grau1,3,14,15,16. É relatada também sua relação com
maior potencial de malignização de tais
neoplasias1,17. Contudo sua expressão é quase nula em mucosa
colônica normal e em pólipos e
adenomas8,15. Considera-se também a hipótese de que, independentemente do
grau histopatológico, a MUC1 seria uma importante
preditora de potencial metastático e
prognóstico1,5,9,15,16.
OBJETIVOS
O objetivo desse estudo foi estabelecer e identificar um marcador biológico que pudesse predizer
a agressividade de um tumor encontrado em estágios
mais precoces de evolução e a relação entre o grau
de agressividade do câncer colorretal de acordo com
os sistemas de estadiamento TNM e
Astler-Coller18,19,20 e a expressão do marcador tumoral MUC1 em
uma determinada amostra de pacientes portadores de
tal neoplasia, tratados pelo Serviço de Coloproctologia
do Hospital Universitário Prof. Alberto Antunes da
Universidade Federal de Alagoas.
MATERIAL E MÉTODO
Foram analisados 36 tumores primários de
pacientes com câncer colorretal incluídos no estudo
aleatoriamente, independentemente de sexo, idade ou
raça. As peças cirúrgicas foram obtidas através
de ressecções terapêuticas realizadas no Hospital
Universitário Prof. Alberto Antunes da Faculdade de
Medicina da Universidade Federal de Alagoas (UFAL)
entre os anos de 2004 e 2007.
As técnicas operatórias utilizadas foram
individualizadas para cada paciente e
incluíram Colectomias, Hemicolectomias,
Retossigmoidectomias, Amputações Abdomino-Perineais e Laparotomias
convencionais. As peças cirúrgicas retiradas passaram
por todo o procedimento anátomo-patológico padrão,
desde sua fixação em formaldeído a 10% até sua
inclusão em blocos de parafina.
Foram escolhidos os blocos de parafina que continham a maior representatividade de tecido
tumoral e as menores áreas de necrose de cada peça para
serem então enviados ao patologista responsável
pela imuno-histoquímica dos tecidos. Este desconhecia
os laudos anátomo-patológicos dos casos
apresentados, analisando-os, portanto, de forma "cega". Os
laudos foram obtidos dos arquivos do Serviço de
Anatomia Patológica do HUPAA.
O protocolo para a reação de
imuno-histoquímica iniciou-se com a desparafinização
dos cortes de 3ìm de espessura inclusos em
lâminas previamente tratadas com
3-Aminopropyltriethoxy-Silano (A3648, Sigma, USA).
O material foi imerso em recipiente de pressão com solução tampão Anidro Cítrico 10mM,
pH 6,0 e lacrado até a pressurização total. Foi dada
seqüência ao processo com a reação de bloqueio
da Peroxidase Endógena com Peróxido de
Hidrogênio a 3%
(H2O2 10 volumes). Após essa reação, o
material foi lavado em solução salina tamponada
com fosfatos (PBS - Phosphate Buffered Saline
10mM, pH 7,4).
Finalmente as lâminas foram incubadas com
o anticorpo primário liofilisado Anti-MUC1
Glicoproteína, Monoclonal de camundongo, Clone Ma695, Isotipo
IgG1 (NCL-MUC-1, Novocastra, United Kingdom), na
diluição de 1:100, em tampão PBS contendo
Albumina Bovina a 1% (BSA, A9647, Sigma, USA) e
Azida Sódica a 0,1% (NaN3) por 30 minutos a 37°C e por
18 horas a 4°C em câmara úmida.
As lâminas foram lavadas em
tampão PBS para então serem incubadas com o anticorpo
secundário, tendo sido usado o LSAB (Biotinylated
anti-rabbit, anti-mouse and anti-goat Ig in PBS) do
kit LSAB+System-HRP (Code K0690, DakoCytomation, Denmark).
Lavadas mais uma vez em tampão PBS, foram incubadas, sendo, neste momento, com o
complexo Streptavidin-HRP (Streptavidin conjugated
to horseradish in PBS) do mesmo kit LSAB+System-HRP.
A lavagem com tampão PBS foi uma
última vez utilizada precedendo a última incubação das
lâminas em solução substrato contendo
3,3' Diaminobenzidina Tetrahidroclorido (DAB)
60mg% (D5637, Sigma, USA), Dimetilsulfóxido
(DMSO), Peróxido de Hidrogênio a 3%
(H2O2 10 volumes) e PBS.
As lâminas foram contracoradas com Hematoxilina de Harris e a montagem feita em
Entellan (1.07961, Merck, Germany) para finalmente
serem analisadas.
A análise da reação imuno-histoquímica
foi realizada por leitura das lâminas em microscópio
óptico com aumento de até 400x. O critério adotado
como positivo para fins de resultados foi o achado
da glicoproteína MUC1 através da ligação com o
anticorpo Anti-MUC1 em padrão citoplasmático nas células
do tecido tumoral pesquisado. Os casos negativos
foram aqueles nos quais se verificou a ausência de tal
padrão de expressão da mesma.
Análise estatística
Trata-se de um estudo para avaliação de
um teste diagnóstico. Analisa-se a Mucina 1 (MUC1)
enquanto marcador da agressividade do câncer
colorretal, correlacionando sua presença com os
estadiamentos TNM e Astler-Coller.
Para estudar a relação entre os critérios
em estudo utilizou-se o teste do Qui Quadrado
(÷2) de Pearson para avaliar a associação entre MUC1 e
os estadiamentos TNM e Astler-Coller.
RESULTADOS
Perfil dos Pacientes
Nos 36 pacientes incluídos no estudo, a
média de idade entre estes foi de aproximadamente 60,25
anos, com variações na faixa etária entre 16 a 86 anos.
Quanto ao sexo, 15 pacientes eram do sexo masculino
(41,67%) e 21, do sexo feminino (58,33%).
Diagnósticos Histopatológicos
A partir da análise dos laudos das biópsias
das peças cirúrgicas pôde-se definir qualitativamente
os casos estudados. Os diagnósticos histopatológicos
dados pelo patologista eram, em todos os casos, de Adenocarcinomas.
Por questões didáticas, analisaram-se os
36 tumores, sob três aspectos diferentes, sendo estes
o grau de diferenciação da neoplasia, a morfologia
do tumor e a qualidade deste de ser mucossecretor
ou não. (Tabela 1).
 |
Estadiamentos TNM e Astler-Coller
Tomando-se conhecimento dos mesmos laudos anátomo-patológicos foram realizadas
avaliações dos estadiamentos TNM e Astler-Coller,
previamente ao estudo imuno-histoquímico, para se definir
o estadiamento dos tumores na amostra colhida. Os
critérios do sistema TNM foram analisados
separadamente. (Gráficos 1 e 2).
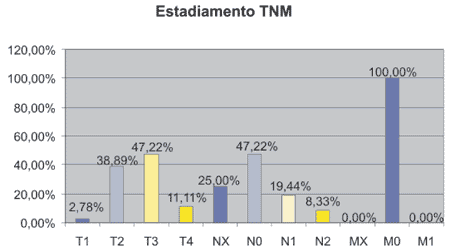 |
Gráfico 1 - Estadiamento TNM. |
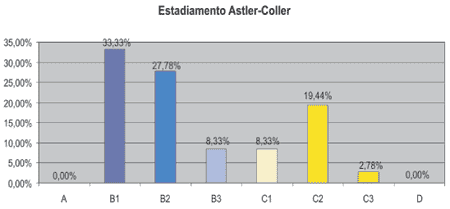 |
Gráfico 2 - Estadiamento Astler-Coller. |
Análise Imuno-histoquímica
Após todo o protocolo da reação
imuno-histoquímica, as lâminas foram avaliadas por um
patologista que desconhecia os resultados acima
expostos. Este constatou, pela análise em microscópio
ótico com aumento de até 400x, a presença
da imunorreação da MUC1 com seu anticorpo, em
padrão citoplasmático em 18 casos (50%). A
positividade foi considerada quando o citoplasma das células
produtoras ou que continham a Mucina 1 corou-se em tom acastanhado, mesmo entremeando células
que não produziam tal glicoproteína. Estas se
mantiveram azuladas. (Figura 1). Casos em que a reação
deu-se em padrão de membrana foram considerados
negativos, assim como tecidos onde não ocorreu a
reação em nenhum tipo de padrão, totalizando estes iguais
18 casos (50%). Percebeu-se a negatividade ao
encontrar todas as células em tons de azul, não
encontrando o tom acastanhado produzido pela reação de
imuno-histoquímica (Figura 2).
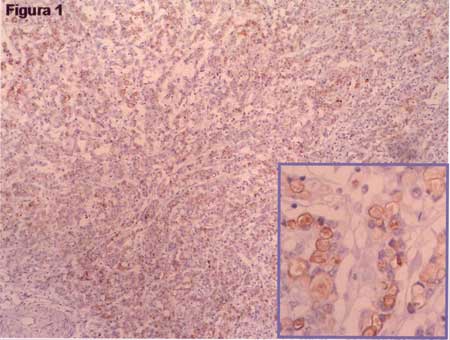 |
Figura 1 - Padrão positivo em adenocarcinoma pouco diferenciado com achados focais de mucossecreção. (T2N0M0, AC: B1). |
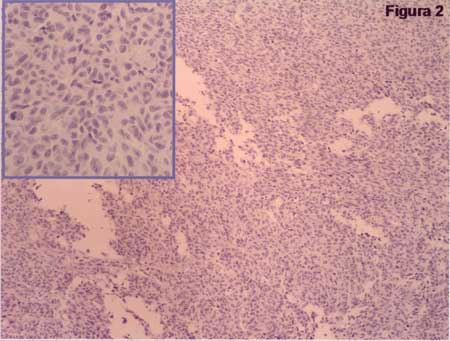 |
Figura 2 - Padrão negativo em adenocarcinoma bem diferenciado de sigmóide. (T2N0M0, AC: B1). |
Relação MUC1 versus
Estadiamentos TNM e Astler-Coller
Após análise detalhada dos resultados das
reações de imuno-histoquímica foi feita a correlação
da positividade destas com os estadiamentos TNM e Astler-Coller. Primeiramente, foram levados em
conta todos os 36 casos e analisada a porcentagem que
cada estádio representava na positividade geral da
Mucina 1. Em seqüência, foi avaliada a porcentagem
de positividade em cada estádio separadamente.
Com relação ao primeiro sistema, o TNM,
este foi desmembrado em seus componentes para uma melhor didática de avaliação de resultados.
Sabendo-se que "T" refere-se ao tumor primário, "N", ao
comprometimento de linfonodos regionais e "M",
às metástases à distância, obtivemos os resultados
expostos na Tabela 2.
 |
 |
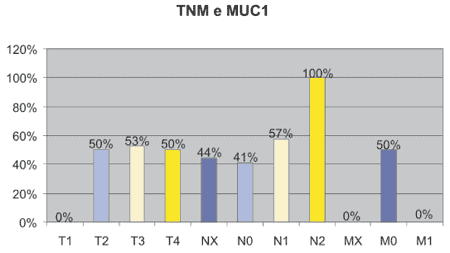 |
Gráfico 3 - Positividade da Mucina 1 por estádio TNM. |
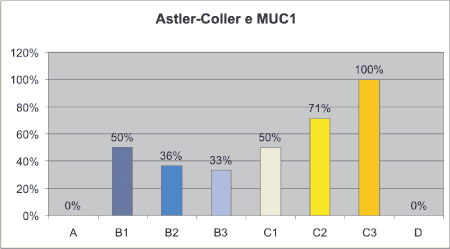 |
Gráfico 4 - Positividade da Mucina 1 por estádio de Astler-Coller. |
DISCUSSÃO
A Mucina 1 (MUC1) é uma glicoproteína
expressa em células de adenocarcinomas colorretais,
e que dificilmente se encontra em mucosa colônica
normal ou em tumores benignos do cólon. Existem
relatos de que a MUC1 teria um papel importante no grau
de malignização das neoplasias
colorretais17.
Várias investigações estão sendo feitas a
cerca dos mecanismos pelos quais a expressão da
MUC1 se relacionaria com a agressividade tumoral,
medida por seu estadiamento, e o prognóstico do paciente,
sabendo-se que o estadiamento é importante para
determinar o grau de sobrevida do paciente. Existem
também teorias sobre um possível aumento do
potencial metastático do câncer independentemente de seu
grau de diferenciação e estadiamento
histopatológico1,5,9,15,16.
Para explicar esses mecanismos várias
hipóteses foram aventadas. Tem-se dito que a MUC1
(i) funcionaria como uma molécula que inibiria a
adesão entre as células, induzindo a liberação destas pelo
tumor para outros sítios e para
circulação22,23; (ii)
agiria como inibidor da interação entre os linfócitos
citotóxicos e as células
tumorais24; (iii) teria papel na adesão
celular à matriz extracelular mediada pela
integrina25; e (iv) seria também supressora da resposta humoral
pela células T induzindo assim uma
imunossupressão26.
Analisando-se as reações
imuno-histoquímicas quanto à expressão da Mucina 1 nos 36 casos
de adenocarcinomas colorretais, foi demonstrado que
a presença desta, tende a ter uma relação com um
maior grau de agressividade dos tumores tendo como parâmetro sistemas TNM e Astler-Coller.
Nos tumores examinados, apesar da igualdade numérica entre casos negativos e positivos,
a imunorreatividade da Mucina 1 manteve discreta
relação com graus crescentes de estadiamento tanto
pelo sistema TNM, como pelo Astler-Coller.
O padrão citoplasmático, que caracterizou
a positividade dos casos, não foi detectado
no estadiamento T1 da casuística, mas estava
presente em carcinomas de estádio T2 e estádio T4. Dos
18 casos positivos, sete (39%) encontravam-se em
estádio T2, enquanto 11 (61%) foram casos de
tumores que ultrapassaram a muscular própria da parede,
caracterizando os estádios T3 e T4, sendo
atribuídos nove casos (50%) a T3 e dois (11%), a T4.
Foram levados em consideração esses dados devido a
maior parte da casuística encontrar-se nos estádios T2
(14/36, 38,89%) e T3 (17/36, 47,22%). Devido a esta
discrepância, analisou-se também a reatividade
da MUC1 dentro de cada estádio. O resultado obtido
foi semelhante entre os casos positivos e negativos.
Os tumores T2 e T4 tiveram resultados relativos
iguais. Dos 14 casos de T2, obteve-se sete casos
positivos (50%). Enquanto que em quatro casos de T4,
dois foram MUC1 positivos, totalizando iguais 50%
de positividade. Porém entre os 17 casos
classificados no estadiamento T3, observou-se discreta
diferença de percentual, sendo nove tumores MUC1
positivos (53%) e oito negativos (47%).
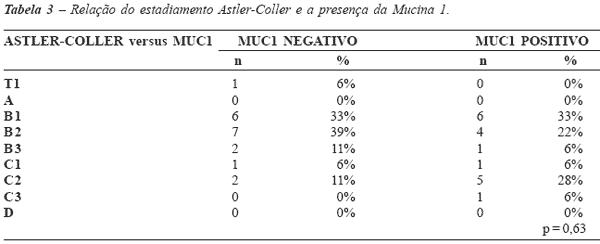
Quanto à presença de linfonodos
regionais acometidos (N), a análise foi realizada
agregando-se os estádios N1 e N2 por ambos caracterizarem a
presença de comprometimento linfonodal diferindo
apenas em sua quantidade. Dessa maneira, entre os
18 casos positivos, foi observada outra igualdade de
porcentagens. Sete tumores (39%) foram
classificados no estádio N0 e outros sete (39%) nos estádios N1
e N2, totalizados quatro casos (22%) N1 e três
(17%) N2. Os quatro restantes (22%) foram
classificados com NX. Dessa maneira não foi possível avaliar
a relação entre a reatividade da MUC1 e
estadiamento "N" em todos os 18 casos positivos, pois esses
quatro casos NX, se avaliados, tanto poderiam ser
estádios de comprometimento linfonodal (N1 ou N2), como
de ausência de acometimento (N0). Todavia, ao se
analisar os estádios individualmente, pôde-se verificar
que tumores NX apresentaram uma positividade para MUC1 de 44% (4/9). Contudo, à avaliação da
porcentagem de Mucina 1 positiva nos estádios
restantes, observou-se que esta aumentou
proporcionalmente ao avanço destes. Foi observada positividade em
41% (7/17), 57% (4/7) e 100% (3/3) dos casos nos
estádios N0, N1 e N2 respectivamente. Dessa
maneira, pôde-se perceber que a MUC1
encontra-se imunorreativa nos estádios mais avançados de
comprometimento linfonodal.
Em todos os 36 casos, não se identificou a
presença de metástases, classificando todos os
cânceres como M0. Assim não foi possível obter resultados
mais significativos quanto a esse critério, sendo,
obviamente, 100% dos casos de positividade estadiados
como M0 e, de todos os casos M0, 50% foram MUC1 reativos.
Analisados os resultados de acordo com o sistema Astler-Coller, estes foram conflitantes no
que se refere à positividade geral, devido à
predominância de dois estádios em detrimento dos outros que
esse sistema apresenta, além da ausência dos estádios A
e D. Exatamente um terço dos 36 casos (12) foram
B1 representando, 33% (6) dos 18 casos positivos. A
classificação B2 respondeu por 10 casos (27,78%)
dos 36 totais, sendo imunorreativos em quatro (22%)
dos 18 MUC1 positivos. Os estádios B3, C1 e C3
responderam, cada um, por 6% dos 18 casos de
positividade, tendo todos respectivamente apenas um caso
positivo. O estádio C2 respondeu por 28% (5 casos)
dos casos de positividade. Esses resultados tiveram o
perfil significativamente alterado quando se avaliou a
porcentagem de positividade por estádio em
separado. Dentre os tumores com estádio B1, a positividade
alcançou metade dos casos, totalizando seis
tumores MUC1 reativos. No estádio B2, a positividade
estava diminuída em relação a B1. Apesar do número
de casos absoluto apresentar uma pequena diferença,
B2 obteve uma positividade de 4 casos em 11 (36%).
A imunorreatividade dos tumores com estádio B3 foi
semelhante ao B2, porém deve-se levar em
consideração o fato de que havia um número menor de
casos com essa classificação. A positividade da Mucina
1 nos casos B3 foi de 33% (1/3). De modo
semelhante ao que aconteceu com a classificação "N", os
estádios subseqüentes de Astler-Coller aumentaram
sua imunorreatividade mesmo com um número
pequeno de casos. Os tumores C1 tiveram uma Mucina 1
positiva em 50% dos casos (1/2). A positividade de
C2 foi ainda maior e com uma quantidade absoluta
de casos também significativamente maior,
totalizando 71% (5/7). Já o único câncer classificado como
C3 obteve uma reação imuno-histoquímica positiva
para a MUC1.
Mesmo sendo um marcador biológico pouco explorado na atualidade, sendo utilizado
apenas com fins de pesquisa, a Mucina 1 tem mostrado
um certo grau de concordância entre sua expressão
e a classificação dos cânceres colorretais mais
agressivos.
Apesar deste estudo não ter apresentado
uma boa significância estatística e um pequeno número
de casos, diversos outros trabalhos, de conceituados
centros de pesquisa, mostram uma estatística bastante
favorável para tal associação. Estes, ao contrário,
tinham a sua disposição uma amostra de tumores bem
mais relevante, onde puderam analisar um leque maior
de estadiamentos que eventualmente não apareceram
em nosso estudo por causas diversas.
O emprego desse marcador rotineiramente
é uma prática pouco utilizada, principalmente aqui
no Brasil, devido à pequena experiência em
reações imuno-histoquímicas dos laboratórios e por este tipo
de reação requerer uma maior experiência, além de
ser muito dispendiosa, necessitando de serviços e
profissionais que tenham a intenção de aprimorar e
atualizar seu arsenal de opções diagnósticas.
Outro fato relevante é a pequena
quantidade de trabalhos acerca do assunto, o que dificulta a
pesquisa neste tópico. Este estudo é pioneiro na
utilização da expressão da Mucina 1 em câncer colorretal
no Brasil e em língua portuguesa, sendo, portanto,
uma possível fonte de novas tendências científicas.
Devido a pequena casuística é de fundamental
importância outros projetos com este enfoque, para que se
possa avaliar, comparar e aprimorar os resultados.
CONCLUSÃO
A ausência de reatividade imuno-histoquímica
à Mucina 1 nas células tumorais não exclui a
possibilidade dessa neoplasia evoluir para um estádio avançado.
Porém, sua presença é sugestiva como marcador de
evolução do câncer colorretal para estádios mais
agressivos em acordo com os sistemas TNM e Astler-Coller.
AGRADECIMENTOS
Agradecimentos especiais a todos os funcionários dos serviços de Anatomia Patológica
e Coloproctologia do Hospital Universitário Prof.
Alberto Antunes - UFAL e do serviço de Anatomia
Patológica da Santa Casa de Misericórdia de Maceió que
tanto contribuíram para o êxito deste trabalho.
ABSTRACT: The expression of tumor markers that correlates with the aggressiveness of cancers has been strongly investigated. Having colorectal cancer a significant incidence, biomarkers that can evaluate it concerning this aspect are not an exception in this inquiry. AIM: To establish a relation between aggressiveness of colorectal cancer according to TNM and Astler-Coller staging systems and the expression of Mucin1 (MUC1) in a determined sample of tumors. METHODS: 36 colorectal cancers resected by proctologists of the University Hospital of UFAL were examined regarding the presence of positive immunohistochemical reaction for MUC1 in cytoplasmic patterns. After that, the positive cases and its stages were correlated. RESULTS: Immunoexpression of MUC1 occurred in 50% of the cases. Among these, 61% were between stages T3 and T4; 39% between N1 and N2; all cases of the study were M0; and 40% were classified between C1 and C3 in Astler-Coller system. When evaluated MUC1 positivity in each stage separately, a proportional increase of both was perceived, mainly in stages "N" and Astler-Coller. CONCLUSION: The absence of imunohistochemical reactivity to MUC1 did not exclude the possibility of evolution for an advanced staged tumor. However, its presence denotes evolution of colorectal cancer for more aggressive stages.
Key words: Mucins, Colorectal Cancer, Cancer Staging, Tumor Markers, Immunohistochemistry.
Referências
1. Grizzle WE, Manne U, Jhala NC, Weiss HL.
Molecular characterization of colorectal neoplasia in translational
research. Arch Pathol Lab Med. 2001 Jan;125(1):91-8. Review.
2. Collaborative Staging Task Force of the American
Joint Committee on Cancer. Collaborative Staging Manual
and Coding Instructions, version 01.03.00. Jointly published
by American Joint Committee on Cancer (Chicago, IL) and
U.S. Department of Health and Human Services (Bethesda,
MD), 2004. NIH Publication Number 04-5496. Incorporates
updates through September 8, 2006.
3. Suzuki H, Shoda J, Kawamoto T, Shinozaki E, Miyahara
N, Hotta S et al. Expression of MUC1 recognized by
monoclonal antibody MY.1E12 is a useful biomarker for
tumor aggressiveness of advanced colon carcinoma. Clin
Exp Metastasis. 2004;21(4):321-9.
4. Ajioka Y, Allison LJ, Jass JR. Significance of MUC1
and MUC2 mucin expression in colorectal cancer. J Clin
Pathol. 1996 July; 49(7): 560_564.
5. Hiraga Y, Tanaka S, Haruma K, Yoshihara M, Sumii
K, Kajiyama G et al. Immunoreactive MUC1 expression at
the deepest invasive portion correlates with prognosis of
colorectal cancer. Oncology. 1998 Jul-Aug;55(4):307-19.
6. Byrd JC, Bresalier RS. Mucins and mucin binding proteins in
colorectal cancer. Cancer Metastasis Rev. 2004 Jan-Jun;23(1-2):77-99.
7. Biermer-Hüttmann AE, Walsh MD, McGuckin MA,
Ajioka Y, Watanabe H, Leggett BA et al. Immunohistochemical
staining patterns of MUC1, MUC2, MUC4, and MUC5AC
mucins in hyperplastic polyps, serrated adenomas, and
traditional adenomas of the colorectum. J Histochem Cytochem.
1999 Aug;47(8):1039-48.
8. Limburg PJ, Ahlquist DA, Gilbert JA, Harrington JJ,
Klee GG, Roche PC. Immunodiscrimination of colorectal
neoplasia using MUC1 antibodies: discrepant findings in tissue
versus stool. Dig Dis Sci. 2000 Mar;45(3):494-9.
9. Baldus SE, Mönig SP, Huxel S, Landsberg S, Hanisch
FG, Engelmann K et al. MUC1 and nuclear beta-catenin
are coexpressed at the invasion front of colorectal carcinomas
and are both correlated with tumor prognosis.
Clin Cancer Res. 2004 Apr 15;10(8):2790-6.
10. Cao Y, Schlag PM, Karsten U. Immunodetection of
epithelial mucin (MUC1, MUC3) and mucin-associated glycotopes
(TF, Tn, and sialosyl-Tn) in benign and malignant lesions of
colonic epithelium: apolar localization corresponds to
malignant transformation. Virchows Arch. 1997 Sep;431(3):159-66.
11. Kim JA, Dayton MA, Aldrich W, Triozzi PL. Modulation
of CD4 cell cytokine production by colon
cancer-associated mucin. Cancer Immunol Immunother. 1999
Dec;48(9):525-32.
12. Koido S, Hara E, Torii A, Homma S, Toyama Y, Kawahara
H et al. Induction of antigen-specific CD4- and
CD8-mediated T-cell responses by fusions of autologous dendritic cells
and metastatic colorectal cancer cells. Int J Cancer. 2005
Nov 20;117(4):587-95.
13. Nakamura H, Hinoda Y, Nakagawa N, Makiguchi Y, Itoh
F, Endo T et al. Detection of circulating anti-MUC1 mucin
core protein antibodies in patients with colorectal cancer.
J Gastroenterol. 1998 Jun;33(3):354-61.
14. Tanimoto T, Tanaka S, Haruma K, Yoshihara M, Sumii
K, Kajiyama G et al. MUC1 expression in intramucosal
colorectal neoplasms. Possible involvement in histogenesis
and progression. Oncology. 1999 Apr;56(3):223-31.
15. Matsuda K, Masaki T, Watanabe T, Kitayama J, Nagawa
H, Muto T et al. Clinical significance of MUC1 and MUC2
mucin and p53 protein expression in colorectal carcinoma. Jpn J
Clin Oncol. 2000 Feb;30(2):89-94.
16. Baldus SE, Mönig SP, Hanisch FG, Zirbes TK, Flucke
U, Oelert S et al. Comparative evaluation of the prognostic
value of MUC1, MUC2, sialyl-Lewis(a) and sialyl-Lewis(x)
antigens in colorectal adenocarcinoma. Histopathology.
2002 May;40(5):440-9.
17. Li A, Goto M, Horinouchi M, Tanaka S, Imai K, Kim YS et
al. Expression of MUC1 and MUC2 mucins and
relationship with cell proliferative activity in human colorectal
neoplasia. Pathol Int. 2001 Nov;51(11):853-60.
18. Astler VB, Coller FA. The prognostic significance of
direct extension of carcinoma of the colon and rectum. Ann
Surg. 1954; 139:846-852
19. Way LW, Doherty GM. Cirurgia: Diagnóstico &
Tratamento. 11ª ed. Rio de Janeiro: Guanabara Koogan, 2004.
20. Towsend CM, Beauchamp RD, Evers BM, Mattox
KL. Sabiston, Tratado de Cirurgia: a base biológica da
moderna prática cirúrgica. Rio de Janeiro: Elsevier, 2005.
21. Landis JR, Koch GG. The measurement of observer
agreement for categorical data. Biometrics 1977; 33:159-74
22. Ligtenberg MJL, Buijs F, Vos HL, Hilkens J. Suppression
of cellular aggregation by high level episialin. Cancer Res.
1992; 52: 2318-2324.
23. Makiguchi Y, Hinoda Y, Imai K. Effect of MUC1 mucin
and anti-adhesion molecule on tumor cell growth. Jpn J
Cancer Res. 1996; 87:505-511.
24. Van de Wiel-Van Kemeade E, Lightenberg MJL, de Boer AJ
et al. Episialin (MUC1) inhibits cytotoxic
lymphocyte-target cell interection. J Immunol. 1993; 151: 767-776.
25. Wesseling J, Van Der Valk SW, Vos HL, Sonnenberg A,
Hilkens J. Episialin (MUC1) over-expression inhibits
intregrin-mediated cell adhesion to extracellular matrix components.
J Cell Biol. 1995; 129: 255-265.
26. Agrawal B, Krants MJ, Reddish M, Longenecked BM.
Cancer-associated MUC1mucin inhibits human T-cell
proliferation, which is reversible by IL-2. Nat Med. 1998; 4: 43-49.
27. Rossi BM, Pinho M. Genética e biologia molecular para
o cirurgião. São Paulo: Lemar, 1999.
28. Manne U, Weiss HL, Grizzle WE. Racial differences in
the prognostic usefulness of MUC1 and MUC2 in
colorectal adenocarcinomas. Clin Cancer Res. 2000 Oct;6(10):4017-25.
29. Ishizu H, Kumagai J, Eishi Y, Takizawa T, Koike M.
Mucin core protein expression by colorectal mucinous
carcinomas with or without mucus hyperplasia. J
Gastroenterol. 2004;39(2):125-32.
30. Dittmann J, Keller-Matschke K, Weinschenk T, Kratt T,
Heck T, Becker HD et al. CD8+ T-cell response against
MUC1-derived peptides in gastrointestinal cancer survivors.
Cancer Immunol Immunother. 2005 Aug;54(8):750-8. Epub 2004
Dec 22.
Endereço para correspondência:
Paula Gabriela Melo Morais
R. Cláudio Ramos, 523/702, Ponta Verde, Maceió - AL
CEP: 57035-020
E-mail: paula_morais@hotmail.com
Recebido em 29/02/2008
Aceito para publicação em 22/04/2008
Trabalho realizado no Serviço de Coloproctologia do Hospital Universitário Prof. Alberto Antunes Faculdade de Medicina da Universidade Federal de Alagoas. Maceió, Alagoas - Brasil.